7月15日,《细胞》(Cell)在线发表了中山大学生命科学学院教授邝栋明、副教授魏瑗团队同合作者最新研究成果。他们首次系统揭示:低碳饮食、抑制葡萄糖代谢这一看似能“饿死”肿瘤的策略,反而可能通过外泌体将TRAIL传递至肺部,显著增加肿瘤肺转移的风险。
记者获悉,该研究由中山大学牵头,联合海军军医大学东方肝胆外科医院、中国科学技术大学等单位共同完成。该项研究不仅发现了上述现象,还提出血浆外泌体TRAIL可作为预测肝癌肺转移的高效生物标志物,为肿瘤患者的早期筛查、干预评估以及靶向治疗提供了全新思路,具有重大的临床意义。
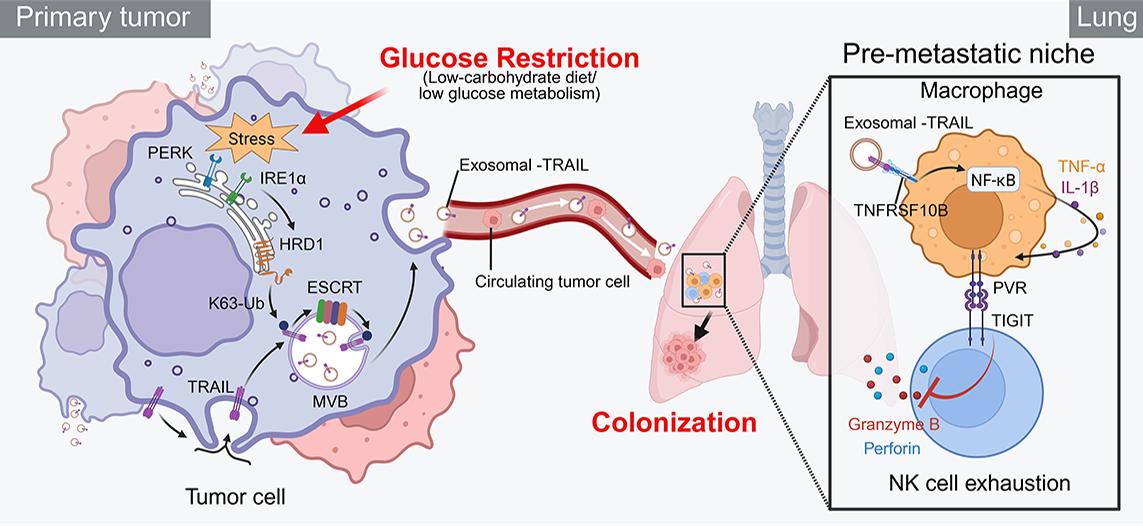
TRAIL介导的免疫耗竭促进转移前生态位形成。研究团队供图
?
传统观点认为,活跃的葡萄糖代谢为肿瘤的生长和扩散提供了能量支持,因此抑制糖代谢的低碳水饮食近年来被视为一种潜在的抗肿瘤策略。然而,邝栋明团队通过分析涵盖15种肿瘤类型的大规模患者数据,有了惊人发现:原发肿瘤葡萄糖代谢活性较低的患者,术后两年内复发风险显著升高。特别是在肝癌患者中,术后发生肺转移者的肿瘤组织糖代谢水平明显低于未发生转移者。这一现象在多种小鼠肿瘤模型中也得到了进一步验证。
值得注意的是,尽管葡萄糖限制会促进肿瘤向肺部转移,但最终在肺部形成的转移灶并非由原本葡萄糖受限的肿瘤细胞直接形成。论文通讯作者邝栋明提出假设:“葡萄糖代谢受限的肿瘤细胞可能并非直接具备更强的转移能力,而是通过‘旁观者效应’影响其邻近的正常代谢肿瘤细胞,从而间接促进转移。”
围绕这一假说,研究团队设计了体内转移模型并反复验证,最终证实葡萄糖低的肿瘤细胞可通过外泌体-免疫轴重塑远端免疫环境,促进代谢正常的细胞发生肺转移。这一发现深化了学界对“代谢-免疫-转移”之间因果链条的理解,也为肿瘤代谢靶向治疗策略的优化提供了理论依据与实验支持。
机制研究揭示了背后的复杂通路。葡萄糖剥夺会诱发肿瘤细胞内质网应激,激活E3泛素连接酶HRD1。该酶会促进死亡配体TRAIL蛋白发生K63位点的泛素化修饰,随后通过ESCRT复合体将其包装进外泌体中并释放入血循环。当这些携带TRAIL的外泌体抵达肺部后,会诱导PVR+巨噬细胞极化,进而通过PVR-TIGIT信号轴,耗竭肺部自然杀伤细胞的关键抗肿瘤免疫功能。这一系列变化最终在肺部营造出一个有利于肿瘤细胞定植的“转移前生态位”。
针对这一机制,研究团队提出了干预策略。在多个动物模型中,阻断TIGIT信号通路不仅显著降低了肺部转移负担,对原位肿瘤的生长也表现出抑制作用,这提示TIGIT是干预代谢应激相关转移的潜在新靶点。
此外,研究团队发现,肝癌患者血浆中外泌体携带的TRAIL水平在预测术后肺转移风险方面表现出卓越性能,其敏感性和特异性均显著优于传统的甲胎蛋白标志物及肿瘤体积等指标。这为未来对高风险患者进行早期筛查和精准管理提供了强有力的工具。
相关论文信息:https://doi.org/10.1016/j.cell.2025.06.027
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。