5月7日,《发育细胞》(Developmental Cell)发表了中山大学肿瘤防治中心泌尿外科教授刘卓炜团队最新成果。他们通过整合患者样本分析、多组学技术解析以及临床前模型验证的多维度研究策略,系统阐明组织驻留巨噬细胞在肿瘤微环境中的功能特征及其调控网络。
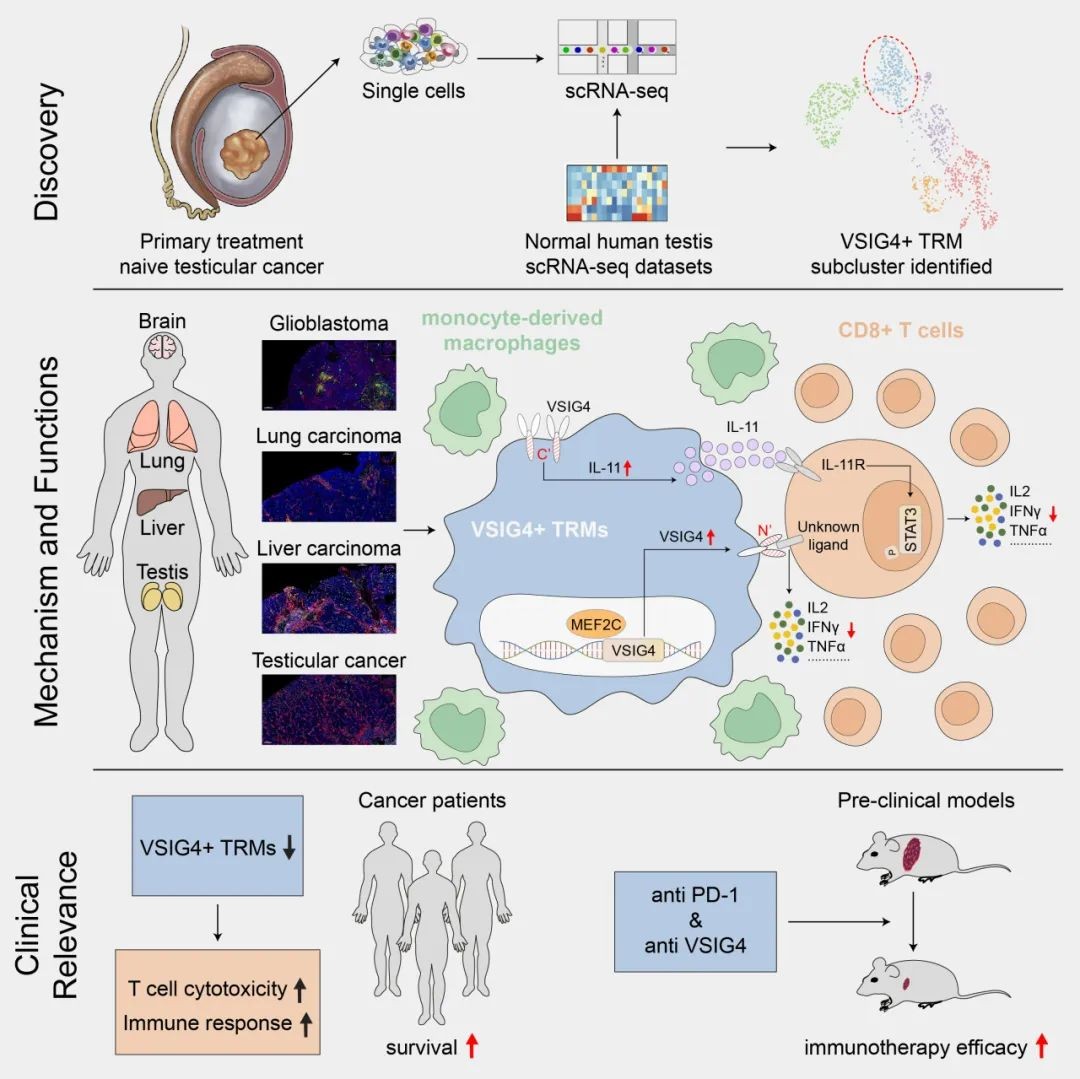 研究机制通路示意图。研究团队供图
研究机制通路示意图。研究团队供图
?
自2011年美国食品药品监督管理局首次批准免疫检查点抑制剂临床应用以来,全球已有近百项适应症获批上市。然而在临床实践中,原发性耐药和获得性耐药问题仍严重制约着治疗效果。近年来的研究表明,肿瘤细胞与微环境之间的异常相互作用是导致耐药的重要机制,其中分布广泛且具有高度可塑性的肿瘤相关巨噬细胞(TAMs)在耐药形成中发挥关键作用。
值得关注的是,TAMs具有双重起源:既可来源于外周循环单核细胞,也可源自组织驻留巨噬细胞。目前通过靶向单核细胞来源TAMs (如CCL2/CCR2、CSF1/CSF1R通路)的治疗策略在临床试验中未能取得预期效果。
随着研究的深入,组织驻留巨噬细胞源性TAMs作为新型治疗靶点正受到学界重视。这类巨噬细胞起源于胚胎发育期的卵黄囊祖细胞,具有独特的自我更新能力,且在不同组织中表现出显著的功能异质性。然而,由于临床样本难以进行确切的基因溯源分析,目前对组织驻留巨噬细胞源性TAMs在肿瘤进展中的具体作用机制仍缺乏深入认知。
该研究中,刘卓炜团队通过单细胞测序和谱系追踪技术,在人睾丸癌组织和小鼠的多个正常组织中,发现了一类组织驻留巨噬细胞起源的VSIG4+巨噬细胞亚群,并在肝癌、肺癌等多种实体瘤中验证其广泛存在。临床队列分析显示,VSIG4+ TAMs的高比例与睾丸癌和肝癌患者较短的生存时间和肿瘤晚期、血管侵犯等不良预后因素显著相关。
随后的机制研究发现:VSIG4+ TAMs既可以通过膜表面VSIG4蛋白直接抑制CD8+ T细胞活性,还可以同时通过促进分泌IL-11激活T细胞STAT3信号通路诱导T细胞失能;转录因子MEF2C是维持VSIG4+ TAMs形成和功能的关键转录因子,抑制MEF2C可显著逆转免疫抑制微环境;在多个临床前模型中,靶向VSIG4+ TAM可抑制肿瘤生长,并增敏免疫治疗疗效。
该研究阐明组织驻留巨噬细胞源性TAMs通过VSIG4/IL-11轴介导免疫抑制的分子机制,为开发靶向TRM起源TAMs的联合治疗策略提供了重要理论依据。
相关论文信息:https://doi.org/10.1016/j.devcel.2025.04.011
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。