中国科学院上海药物研究所研究员黄河团队,联合复旦大学附属华山医院主任药师李群益团队、华中科技大学同济医学院附属同济医院副主任医师梅齐团队,揭示了结直肠癌(CRC)中N-糖基化修饰的代谢调控特征及其临床相关性,为CRC的诊断、预后评估和靶向治疗提供了新的见解和潜在干预靶点。4月26日,相关研究发表于《先进科学》。
CRC是全球常见的恶性肿瘤之一,其发生发展与代谢改变密切相关,其中N-糖基化失调在CRC进程中发挥关键作用。阐明N-糖基化修饰驱动CRC发生发展的潜在分子机制,鉴定新的药物靶点,对CRC的药物开发以及临床治疗具有重要意义。然而,目前对CRC中N-糖基化的代谢调控机制及功能意义仍缺乏系统认知。
研究团队对45例CRC组织及其配对癌旁正常组织进行了全面的蛋白质组学和N-糖基化完整糖肽(IGPs)分析,共鉴定出7125种IGPs,对应于704种糖蛋白。通过分析IGPs表达谱和结构特征,研究人员构建了糖型-糖基化位点-蛋白功能多维关联网络,系统揭示了N-糖基化介导的CRC中功能失调图谱。此外,研究团队开发了一种整合不同糖型丰度差异表达的算术模型,不仅可准确区分肿瘤和正常组织,还揭示了CRC特异的代谢重编程特征。
研究团队进一步发现并证实,联合氯离子通道辅助蛋白1(CLCA1)和嗅素蛋白4(OLFM4)是CRC诊断的潜在生物标志物。值得注意的是,研究团队揭示了脂肪细胞质膜相关蛋白(APMAP)N196位点的特定N-糖基化在CRC进展中的关键作用,为靶向干预提供了潜在靶点。
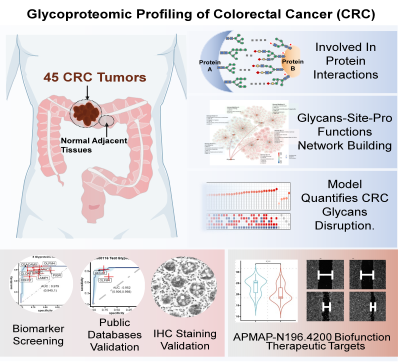 糖基化修饰调控结直肠癌发生和进展。图片由研究团队提供
糖基化修饰调控结直肠癌发生和进展。图片由研究团队提供
?
相关论文信息:https://doi.org/10.1002/advs.202415645
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。