在兰州大学第二医院泌尿外科的诊室里,65岁的张先生(化名)攥着检查报告,报告上“膀胱癌晚期,化疗耐药”的字样像一把利刃,刺痛着他本就脆弱的神经,如果切除了膀胱,以后的尿液只能从肚子上排出,对生活会造成很大影响。“医生,真的没有别的办法了吗?”这样的场景,泌尿外科王志平教授已见过太多。
“现有治疗手段的有效率不足50%,许多患者不是死于疾病本身,而是死于化疗的毒性或耐药后的无药可用。”王志平的语气沉重,却也透着坚定,“但这一次,我们可能真的找到了突破口。”
他口中的“突破口”,正是兰州大学第二医院泌尿外科王志平教授团队与兰州大学药学院刘映前教授团队跨界合作、历时数年合作,从小分子的抗肿瘤研发到靶向FGFR3(成纤维细胞生长因子受体3)的膀胱癌抗体偶联药物(ADC)——LZU-WZLYFG001的进阶。这款候选药物不仅在临床前研究中展现出“高效低毒”的突出优势,更有望为耐药膀胱癌患者打开一扇希望之窗。相关论文发表于《先进科学》(Advanced Science)。
 王志平(中间)在手术中。受访者供图。
王志平(中间)在手术中。受访者供图。
“患者的绝望,是我们科研的起点”
从1982年开始,王志平的职业生涯,始终与膀胱癌诊治紧密相连。作为西北地区泌尿外科的领军人物,他见证了无数患者从确诊到治疗、再到耐药或复发的全过程。
“膀胱癌是泌尿系统最常见的恶性肿瘤之一,尤其是晚期患者,五年生存率不足20%。”他翻开一本的病例册,指着其中一页说,“这位患者,今年确诊时已经60岁,经历了化疗、免疫治疗,包括切除手术,最终还是因为耐药复发,肿瘤在全身转移后去世。临终前,他的家属拉着我的手说‘王医生,有没有其他更好地办法,让他活下去’……”
这样的遗憾,成为王志平心中挥之不去的结,“患者的绝望,是我们科研的起点。”
与此同时,在兰州大学药学院的实验室里,刘映前教授也在为小分子药物的研发瓶颈而苦恼。
“传统化疗药物像‘炸弹’,不分敌我地攻击所有细胞,导致患者承受巨大的毒性反应。”他表示,“我们曾筛选出上百种活性优异的先导化合物,但动物实验中,它们因为毒性太强无法推进,严重制约了其临床应用前景。”
在2017年的一次学术会议上,两位教授聊起各自科研遇到的瓶颈,聊起膀胱癌治疗的困境,竟发现彼此的研究方向存在惊人的互补性——“如果能开发一种药物,既能精准识别癌细胞,又能高效杀伤且毒性可控,那该多好?”
这个念头,像一颗火种,点燃了两支团队的科研热情。
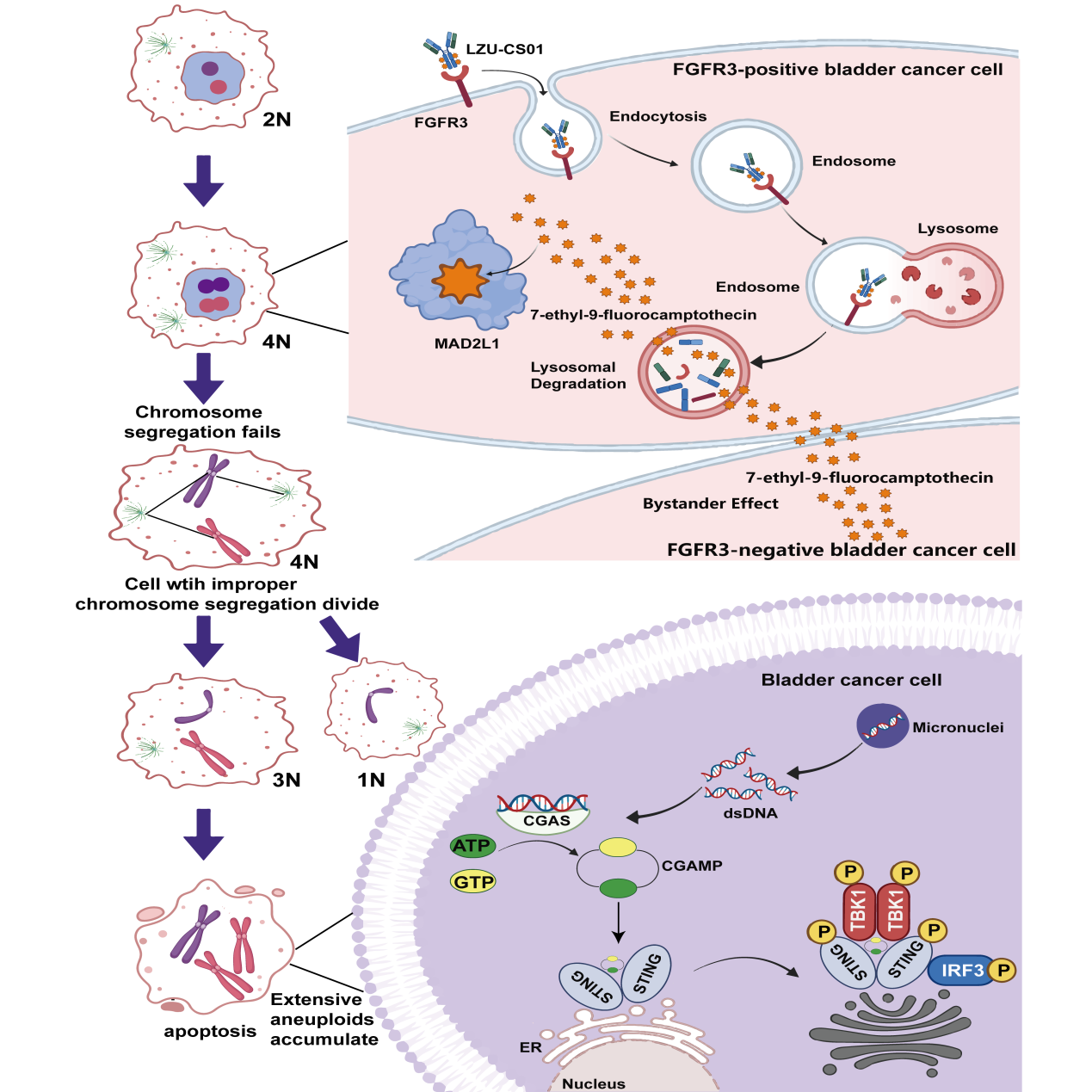
LZU-WZLYCS01作用机制示意图。兰州大学供图。
“科研不是单打独斗,而是接力赛”
ADC药物(抗体偶联药物)的概念并不新,其技术的独特优势在于能够实现“精准递送”与“高效杀伤”的完美结合——通过将高活性细胞毒性化合物与特异性靶向系统有机结合,既充分发挥了强效抗肿瘤作用,又通过靶向递送机制显著降低了系统毒性。
但要将这一理念转化为临床可用的药物,却需要跨越抗体设计、连接子稳定性、高效释放活性毒素等多重技术鸿沟。
“最初,我们像两个独立的军团,各自为战。”刘映前回忆道,“药学院擅长分子设计,但缺乏对临床需求的深刻理解;泌尿外科掌握患者数据,却不懂如何将临床问题转化为科研问题。”
项目初期,团队在ADC分子构建中遭遇了致命瓶颈——药物的化学特性导致它难以与连接子稳定结合,这成了工艺上一个巨大的挑战。“我们尝试了上百种组合,但大多数在体外实验中就失败了。”刘映前说,“这本来可能是一个令人沮丧的时刻,但团队的反应却出乎意料的流畅和高效。没有抱怨,没有纠结,我们迅速启动了一场‘跨学科会诊’。 ”
会上,研究团队决定立刻从化合物库中调取备份数据,寻找其他活性相当、但更易于“装配”的候选者。就在那次关键的讨论中,双方共同做出了一个果断的决策: 为了项目的整体进度,暂时搁置该药物的路线,集中力量推进备选方案—也就是后来成为LZU-WZLYFG001核心的DXD毒素。
所谓DXD毒素,可以理解为高能弹头,它能抑制拓扑异构酶I,导致肿瘤细胞DNA严重损伤并最终凋亡。
同时,在靶点选择上,团队基于充分的临床证据与实验验证,最终将研究焦点锁定于FGFR3这一关键靶点。王志平说:“约有18%的膀胱癌患者存在FGFR3基因的激活突变,这本身就是一种明确的致癌驱动因素。更为重要的是,即使在不存在突变的患者群体中,FGFR3蛋白也在很大比例的肿瘤组织中呈现显著的过表达状态。这种广泛的存在,使其成为一个能够覆盖大量患者群体的理想靶标。”
这两种方案的结合,让团队豁然开朗——FGFR3不仅是理想的靶点,其抗体本身还能通过阻断信号通路抑制肿瘤增殖,形成“靶向+抑制”的双重机制。
“就像给导弹装上了导航系统,既能精准定位,又能主动攻击。”王志平比喻道,特异抗体作为精准导航,将“弹头”药物精准送达癌细胞;通过内吞作用,整个药物被“吞”进细胞;随后连接子在溶酶体内被切断,释放出DXD弹头,从内部精确爆破癌细胞。
得益于ADC“精准递送、细胞毒增效”的先天优势,在动物实验中,它展现出了意想不到的疗效——不仅对化疗敏感的肿瘤有效,更能显著缩小化疗耐药肿瘤的体积。
“这让我们看到了希望,证明我们的方向是对的。那个缩小的肿瘤,是我们对规律理解正确的一次验证,这种与自然对话并得到回应的感觉,让人充满敬畏。”刘映前说,“科研不是单打独斗,与其说是我们在努力‘协调分歧’,不如说我们完美地完成了一场‘无缝衔接’的科学接力。”
团队从一开始就建立了一种“各司其职,又同舟共济”的默契。王志平表示,药学院的研究是“武器设计师”,他们专注于分子结构的精妙设计、化合物的高效合成,确保拥有最具威力的“弹头”;而泌尿外科的临床专家则是“前线指挥官”,他们基于最真实的临床需求,定义“武器”的性能指标,并在最接近真实战场的PDX模型和类器官模型中验证其威力。
“科学需要严谨,但更需要温度”
尽管动物实验结果令人振奋,但双方始终保持谨慎。“我们正处在从“原理验证”到“临床转化”最关键、也是最艰难的阶段。实验室的成功只是第一步,真正的考验在临床。”他强调,“我们当前最大的挑战,是完成系统性的、符合临床申报标准的药效与安全性验证。”
这远不止是重复在初期研究中已成功的实验。它意味着团队需要在更接近人类疾病的复杂模型、更长的观察周期和更严格的质控标准下,无可争议地证明两件事:第一,药物在不同背景的膀胱癌模型中均能稳定地复制出卓越的疗效;第二,它的安全性特征足以支撑其进入人体试验。
如今,LZU-WZLYFG001的后续研究和转化流程正在紧锣密鼓地进行中。团队已经与国内行业龙头企业建立了紧密的合作伙伴关系,共同优化和完善临床前研究体系,确保数据的高质量与可靠性;同时协同推进生产工艺的放大与优化,为未来的临床试验提供稳定、合规的药品供应。
“这是一个庞大而精密的系统工程,包括了药理、毒理、药代动力学等全方位的深入评估。我们必须生成一套完整、坚实、经得起最严格审视的数据,才能将其进一步向临床转化。”刘映前表示,这个过程不仅是对药物本身的考验,更是对团队科学严谨性和执行力的终极检验。
“科学需要严谨,但更需要温度。”王志平说:“我们正全神贯注于这“临门一脚”的准备工作。跨越这一步,我们就能将实验室里的希望,真正转化为患者床边触手可及的治疗选项。”
据了解,该药物目前已经完成了最核心的概念验证与知识产权布局,已经积极与产业界的战略合作伙伴协同推进生产工艺的优化以确保未来能够稳定、合规地生产出用于临床试验的药品。王志平强调,“我们的最终目标,是将这款源自实验室的原创成果,真正转化为能够惠及广大膀胱癌患者、解决临床难治性膀胱癌治疗的创新药物,为提升我国膀胱癌的治疗水平贡献一份力量。”
对于未来,两位教授充满了期待与信心。他们希望,通过科研创新,能够为膀胱癌患者带来更加精准、高效的治疗手段,让更多患者和他们的家庭看到实实在在的生命希望。“请相信科学,我们一直在为患者的生命希望寻找每一个可能。”这也是王志平和刘映前两位教授最想对膀胱癌患者和家属说的话。
相关论文链接:https://doi.org/10.1002/advs.202509933
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。