中国科学院广州生物医药与健康研究院研究员巫林平团队与华中科技大学协和医院教授孙家明团队合作,成功构建一种微纳结构与力学性能可调控的多孔气凝胶库,揭示了仿生三维微环境的孔隙结构与力学强度对人源诱导多能干细胞(hiPSCs)来源的运动神经前体细胞(MNPs)谱系命运调控作用和关键分子机制,并验证了其在脊髓损伤修复中的功能再生潜力。相关成果近日发表于《今日材料-生物》(Materials Today Bio)。
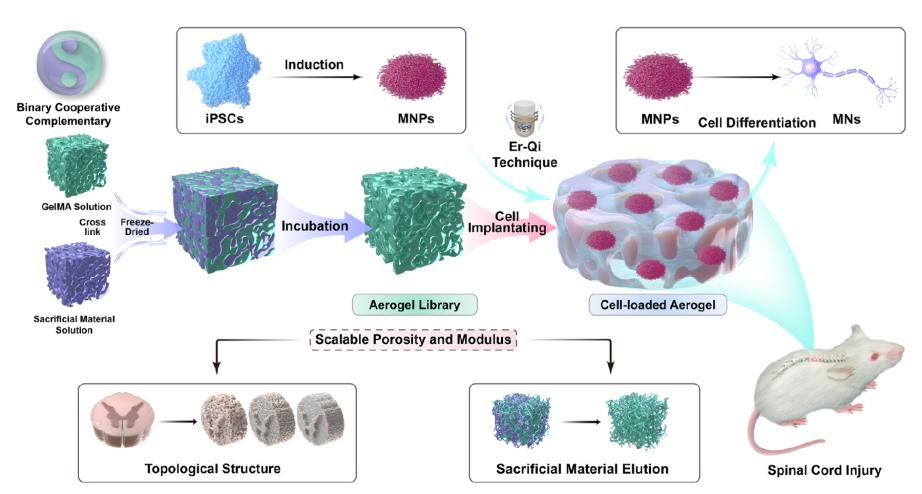
具有不同多孔结构和力学性能的气凝胶库调控运动神经元分化的研究示意图。研究团队供图
在脊髓损伤微环境中,外源细胞移植常面临生存率低、分化谱系不稳定和功能整合效率不足等挑战。针对这些问题,研究团队通过精确调控气凝胶支架的孔径分布(范围10–100 μm)与弹性模量(范围0.1-1.0 kPa),获得一系列具有不同拓扑结构及力学特性的三维仿生凝胶。研究发现,孔径20 μm且模量0.4 kPa的仿生支架适配MNPs存活、轴突定向生长及ChAT+运动神经元(MNs)分化,揭示了物理微环境在干细胞调控神经分化过程中的主导作用。机制研究显示,仿生材料可通过激活Yes相关蛋白(YAP)的核转位驱动MNs分化,而抑制YAP信号则会阻断该促进作用,进一步证实YAP介导的机械信号感应是该仿生体系调控MNs命运的关键途径。
该研究证实,仿生凝胶通过微纳结构与力学性能的协同调控,在脊髓损伤区域有效招募宿主内皮细胞并显著抑制炎症级联反应。通过重塑支持神经发生的微环境,显著提高了移植MNP的存活率及功能性MN的定向分化与成熟。此外,仿生凝胶进一步通过促进脊髓组织结构的重建,从而支持局部神经环路的恢复,并最终显著改善了脊髓损伤小鼠的后肢运动功能。
该研究为脊髓损伤修复领域提供了一种结合仿生材料与细胞治疗的协同新策略。
相关论文信息:https://doi.org/10.1016/j.mtbio.2025.102404
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。