华南师范大学生命科学学院教授高彩吉团队同合作者,研究揭示了在热激条件下,自噬相关蛋白被招募到应激颗粒中,而在热激解除后,这些蛋白被重新释放回细胞质,促进了由热胁迫引起的不可溶性蛋白的降解。2024年12月30日,相关成果发表于《自然-通讯》(Nature Communications)。
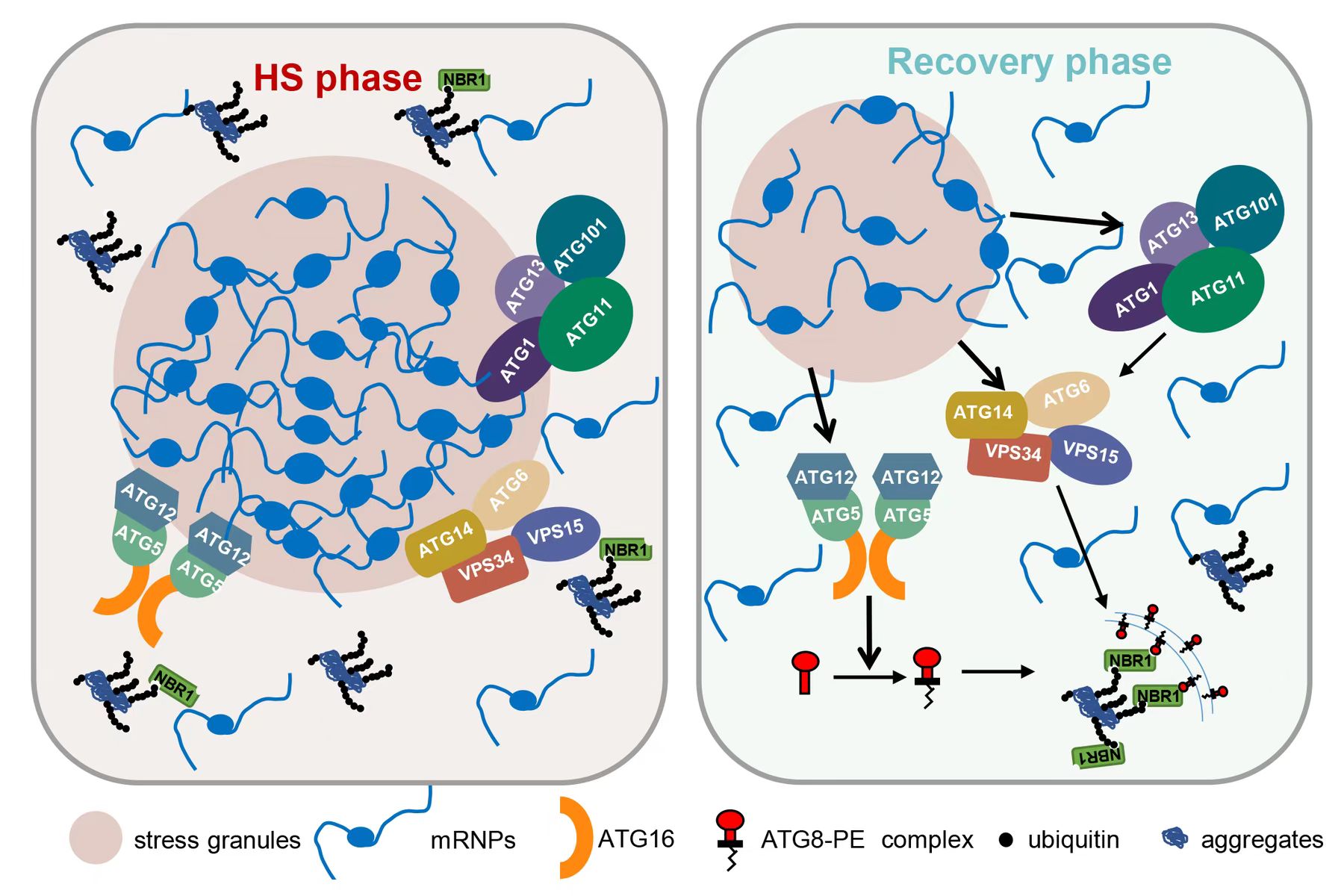 应激颗粒调控热胁迫过程中自噬活性的工作模型。研究团队供图
应激颗粒调控热胁迫过程中自噬活性的工作模型。研究团队供图
?
在自然界中,热胁迫是影响植物生长和发育的重要因素之一。热胁迫会导致植物细胞内积累大量不可溶性蛋白,严重威胁植物的正常生长。植物细胞自噬在此过程中扮演着清除不可溶性蛋白的关键角色,其功能的任何突变都可能导致不可溶性蛋白积累,最终引发植物死亡。尽管已有研究表明热激后自噬相关蛋白的基因表达水平显著上调,但自噬蛋白在亚细胞水平上的调控机制尚不明确。
研究团队前期揭示了短时间高温(45℃,5分钟)后,自噬相关蛋白8(ATG8)聚集到了囊泡状的顺式高尔基体上,进而介导了热胁迫后的高尔基体的损伤修复。为了进一步全面了解核心的自噬相关蛋白在热激过程中的动态变化,团队对不同的自噬相关蛋白稳定转基因植物进行了热胁迫处理(38℃,60分钟),发现自噬上游蛋白,如ATG1/13复合物(ATG1a,ATG13a)、PI3K复合物(ATG6,VPS34)、ATG12-ATG5类泛素化系统,在热激条件下形成了大量的点状信号。进一步的实验显示,这些自噬蛋白与热胁迫产生的非膜细胞器—应激颗粒共定位,而非与膜包被的细胞器共定位。
通过生化和细胞生物学手段,研究团队验证了自噬相关蛋白在热激下特异性地招募到应激颗粒,并在热恢复阶段随着应激颗粒的解聚而回到细胞质中。此外,通过CRISPR-Cas9技术获得的ubp1abc三突变体显示,应激颗粒的数量显著降低,在热胁迫后自噬体的形成时间显著延迟,表明应激颗粒在调控热胁迫过程中自噬活性中发挥了重要作用。生化分析进一步发现,在ubp1abc突变体中积累了过量泛素化不可溶蛋白。
该研究结合生物化学以及细胞生物学等分析手段,揭示了植物应激颗粒在热胁迫下调控自噬活性的分子机制,揭示了全新的植物应激颗粒的功能并进一步拓宽了热胁迫中自噬活性调控的分子机理。
上述研究得到国家自然科学基金面上项目和青年项目、“十四五”广东省农业科技创新十大主攻方向揭榜挂帅项目、广东省自然科学基金面上项目和杰出青年项目、香港研究资助局基金项目等支持。
相关论文信息:https://doi.org/10.1038/s41467-024-55292-w
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。