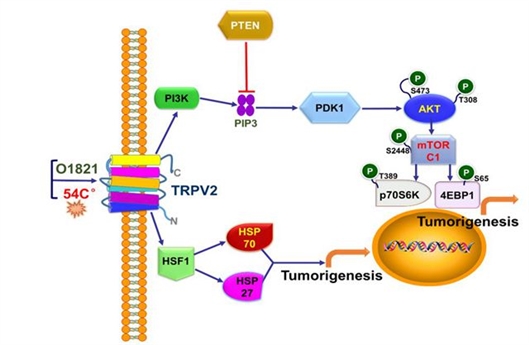
热应激参与TRPV2促进食管鳞状细胞癌的肿瘤发生示意图。研究团队 供图
近日,英国癌症杂志(British Journal of Cancer)与英国癌症研究中心(Cancer Research UK)联合发表了中国科学院广州生物医药与健康研究院研究员李志远团队的最新研究成果。他们不仅揭示了瞬时受体电位离子通道香草素亚型2(transient receptor potential vanilloid 2,TRPV2)通道在食管鳞癌发生发展过程中扮演的重要角色,也为食管鳞癌的防治提出新的方向。
该研究首次发现,热敏型TRPV2反复受热或激动剂作用可激活HSP70/27和PI3K/Akt/mTOR信号通路,在体外实验中可显著促进食管鳞癌细胞的恶性行为,在体内则可显著促进食管鳞癌的成瘤和扩散。
食管癌是全球、也是我国高发的恶性肿瘤之一,据2020年国际癌症数据,全球超过一半的新发食管癌集中在我国,其在我国的发病率和死亡率列于全部恶性肿瘤的第5位和第4位,严重威胁我国居民的生命健康。食管癌主要包括腺癌和鳞癌(ESCC),我国食管癌90%以上为鳞癌。食管癌确诊时多数已进展至中晚期,患者总体5年生存率不足20%。
已知食管癌的发病及进展与多基因异常有关,而外界环境因素,特别是高温饮食被认为是引起食管鳞癌的主要风险因素之一,高温饮食往往使得食管黏膜经受频繁、反复的热刺激,导致食管黏膜上皮细胞功能变异风险增加。实际上,高热刺激已被国际癌症研究署列为食管癌的二类病因之一,然而,目前对其内在分子机制仍知之甚少。
为此,李志远团队基于多年对瞬时受体电位离子通道(TRP)的研究基础,首先检测了热敏型TRPV在人食管鳞状上皮细胞的表达和功能,发现与非瘤组织相比,ESCC细胞和临床ESCC样本中的TRPV2表达均明显上调,钙成像实验证实其功能活动相应增强。
进一步研究发现,以激活TRPV2通道的热(54°C)对ESCC细胞进行短暂而频繁的刺激后,在体外实验中可明显增强ESCC细胞的增殖、侵袭和促血管生成等恶性细胞行为,而体内实验则可显著促进裸鼠皮下成瘤和尾静脉注射的肿瘤转移。使用TRPV2特异激活剂O1821作用于ESCC细胞后,也取得类似结果。反之,TRPV2拮抗剂Tranilast的应用或经CRISPR-Cas9方法敲除ESCC细胞的TRPV2基因后,上述的ESCC致瘤作用均显著减弱。另外,将TRPV2过表达于非瘤食管鳞状细胞NE2后,以热(54°C)和O1821对NE2细胞进行短暂而频繁的作用后可显著促进NE2的增殖,使其呈现侵袭性并在裸鼠皮下成瘤,说明过表达过激活的TRPV2可使非肿瘤细胞转向肿瘤化。
在机制上,TRPV2在ESCC细胞经热应激激活后可上调细胞的热休克因子1(HSF1)并促进热休克蛋白70和27(HSP70/27)的转录表达,从而促进ESCC的成瘤性;同时PI3K在此过程中显著激活,进而激活其下游信号蛋白PDK1,随后PDK1上调靶蛋白AKT1和mTORC1的功能,反之,PI3K的负调控蛋白PTEN受到下调抑制,说明PI3K信号被PTEN放大,从而显著促进ESCC的成瘤性和侵袭力。激活的TRPV2还上调Akt蛋白的S473和T308位点的磷酸化水平,而p-mTOR(S2448)和效应蛋白磷酸化水平p-p70S6K(T389)和p-4EBP1(S65)均相应提升;Tranilast的应用或TRPV2基因敲除则抑制上述作用。
该研究还发现pan-PI3K/mTOR激酶抑制剂VS5584和Oroxin B可显著抑制TRPV2过激活的ESCC细胞增殖,两者与Tranilast合用可进一步削弱ESCC细胞的增殖能力,提示Tranilast联合pan-PI3K/mTOR抑制剂可能可用于ESCC的治疗。多因素生存分析提示TPRV2高表达是ESCC患者预后不良的独立因素,表明TRPV2有望成为ESCC不良预后的生物标志物和新的治疗靶点。
值得注意的是,该研究发现的TRPV2通道的激活温度54°C,低于许多人群中的膳食温度,也远低于国际癌症研究署建议的高温饮食风险温度(65°C),因此,该研究为食管鳞癌的防治提出了新的方向。
中国科学院广州生物医药与健康研究院黄荣奇博士为该论文第一作者,李志远研究员为通讯作者。相关研究工作得到了香港大学李嘉诚医学院、中南大学湘雅二医院及湖南省肿瘤医院的支持,也得到中国科学院广州生物医药与健康研究院研究员李鹏、赖良学等多个研究组的协助。
该研究获得了国家自然科学基金、广东省以及生物岛实验室前沿研究项目的资助。
相关论文信息:https://www.nature.com/articles/s41416-022-01896-2
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。