中国科学院南海海洋研究所研究员王晓雪团队首次发现丝状原噬菌体编码的核心基因与共存原噬菌体编码的毒素-抗毒素(TA)系统间的互作机制,为理解多重溶原菌的生物学功能及开发新型抗菌策略提供了重要的理论依据。相关成果近日在线发表于《自然-通讯》(Nature Communications)。
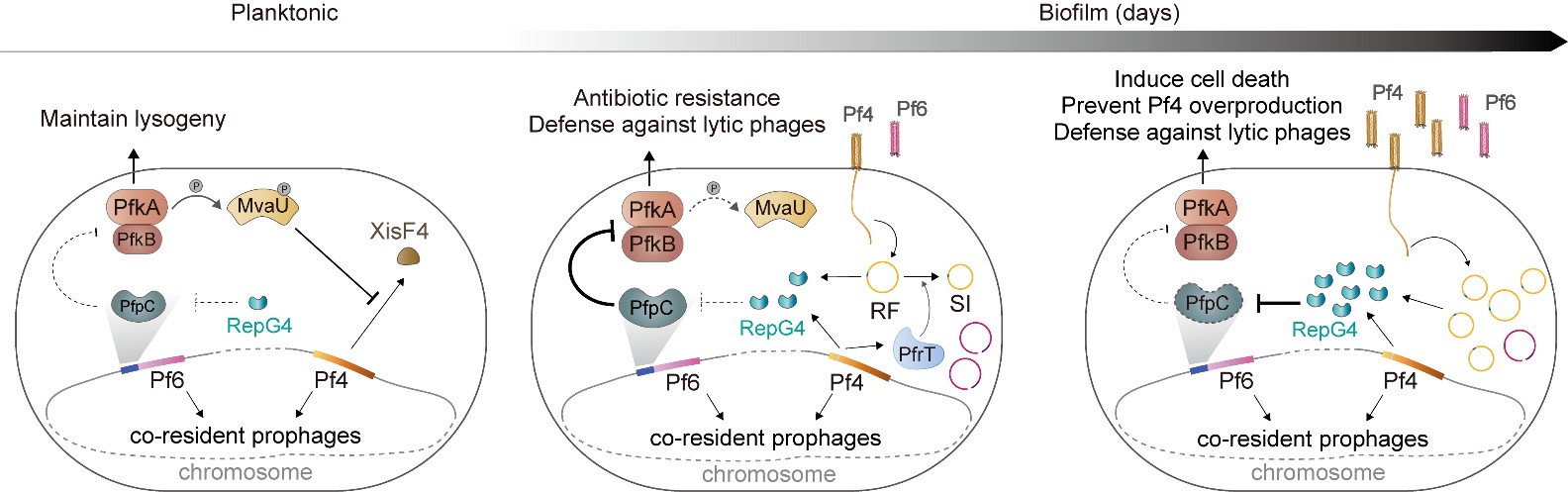 噬菌体Pf6的TA系统KKP监控Pf4的复制蛋白实现两个噬菌体有序激活释放。研究团队供图
噬菌体Pf6的TA系统KKP监控Pf4的复制蛋白实现两个噬菌体有序激活释放。研究团队供图
?
论文第一作者、中国科学院南海海洋研究所2022级博士研究生古嘉瑜表示,在自然环境中,细菌宿主可被多个温和噬菌体侵染,呈现多重溶原,对细菌宿主的毒力、基因组可塑性及环境适应性具有重要影响。
该研究以生物膜模式菌株铜绿假单胞菌为研究模型,该菌被两个核心基因组高度相似的丝状噬菌体Pf4和Pf6侵染,整合在宿主基因组的不同位点,两个噬菌体在生物膜形成过程中被激活,参与调控生物膜发育与宿主毒力。然而,两个噬菌体之间如何监控细菌宿主环境进行激活,以及生物膜激活中的竞争与协作关系均不明确。
研究团队发现Pf4噬菌体核心区域的复制相关蛋白RepG4可直接结合并降解共存Pf6噬菌体携带的三元TA系统KKP中的抗毒素PfpC,从而激活激酶PfkA/PfkB的毒素毒性。当Pf4复制水平达到一定阈值时,RepG4的积累引发宿主细胞受控死亡,从而限制Pf4过度增殖,并协调两种噬菌体在生物膜成熟阶段的有序释放。
进一步研究表明,尽管Pf4与Pf6核心基因组序列高度相似,它们却演化出截然不同的调控策略:RepG4通过降解抗毒素以控制噬菌体复制强度,而Pf6的同源蛋白RepG6因关键氨基酸位点突变(R49C)而不具备该功能,反而可稳定PfpC,从而保护自身免受毒性激活。这一差异化机制既避免了两者间的过度竞争,又实现了对宿主-病毒稳态的协同维持,有助于增强细菌在生物膜环境中的生存与致病能力。
该研究突破了传统原噬菌体调控研究中“阻遏蛋白-抗阻遏蛋白”的单一认知框架,揭示了原噬菌体核心复制基因与共存原噬菌体辅助毒素-抗毒素系统间的通讯机制。这一发现不仅深化了对多溶原性微生物生态适应策略的理解,也为未来靶向耐药性铜绿假单胞菌感染提供了新思路与潜在干预策略。
相关论文信息:https://doi.org/10.1038/s41467-025-62378-6
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。