在国家重点研发计划、国家自然科学基金等项目资助下,暨南大学研究员闫森团队携手南京大学教授张辰宇/陈熹团队,成功开发出新型基因治疗策略,用于治疗DNA结合蛋白43(TDP-43)相关神经退行性疾病。相关成果近日在线发表于《脑》(Brain)。
肌萎缩侧索硬化症是致命的神经退行性疾病,患者多在发病数年内死亡。约97%的肌萎缩侧索硬化症病例和约45%的额颞叶痴呆病例中,均发现TDP-43阳性包涵体。TDP-43对RNA稳态至关重要,病理状态下,它会从细胞核清除并在细胞质形成聚集体,引发神经退行性病变。此外,TDP-43作为神经退行性疾病的关键病理蛋白,还与阿尔兹海默症、帕金森病和亨廷顿舞蹈症等多种疾病相关。
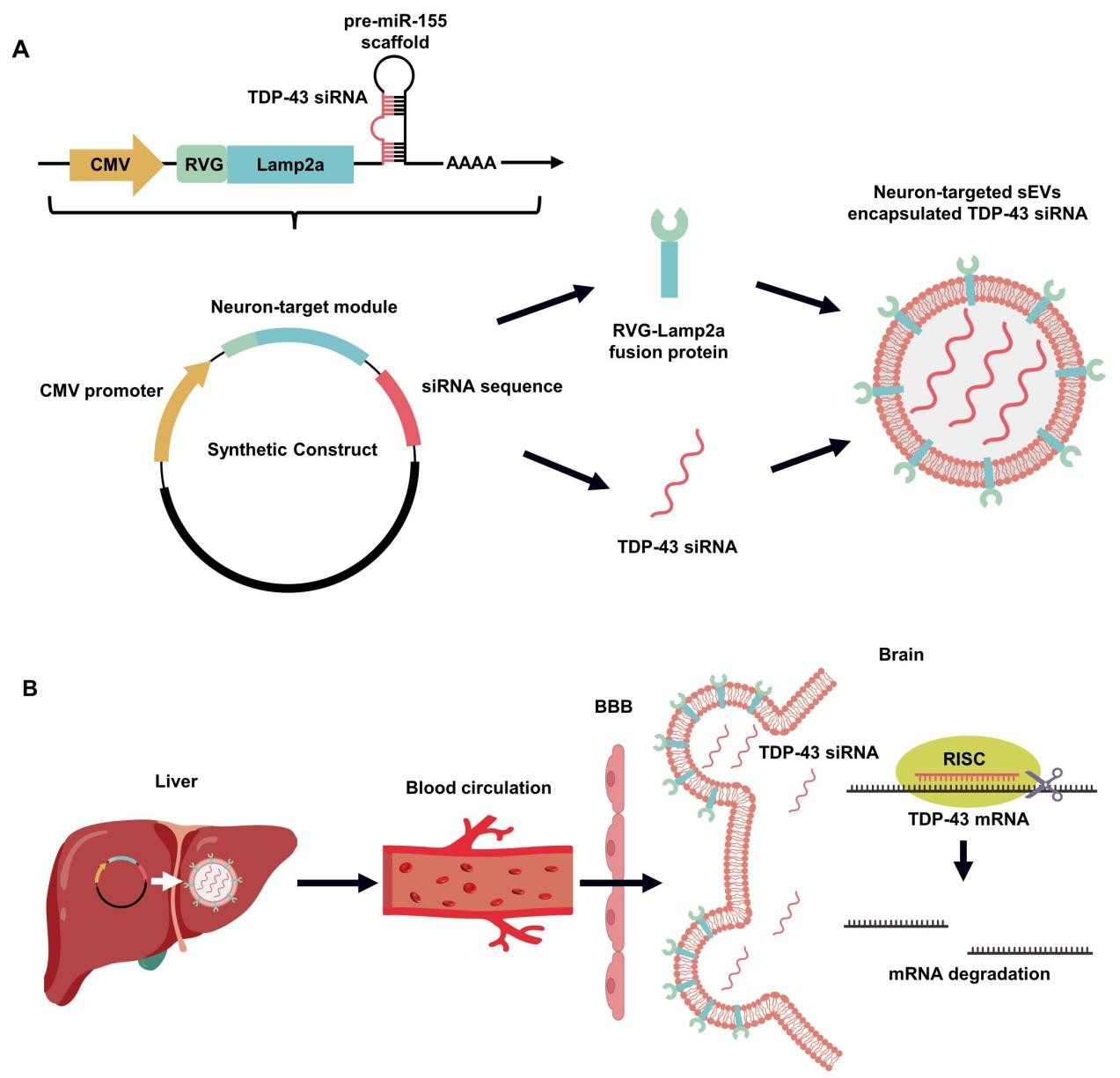 靶向TDP-43的体内自组装siRNAs的设计和原理。研究团队供图
靶向TDP-43的体内自组装siRNAs的设计和原理。研究团队供图
?
RNA干扰(RNAi)通过小核酸分子与靶基因碱基互补配对,特异性抑制其表达,在神经退行性疾病治疗中前景广阔。然而,RNAi应用于此类疾病面临诸多挑战,主要是“递送”难题。传统颅内注射给药有创伤且易引发神经炎症;纳米颗粒载体虽可静脉注射,但存在免疫原性,且难以突破血脑屏障进入中枢神经系统。因此,开发更安全、高效、非侵入性的RNAi给药策略迫在眉睫。
内源性细胞能选择性地将miRNA包装到小细胞外囊泡中,后者可携带miRNA递送至受体细胞,抑制靶基因表达。小细胞外囊泡具有低免疫原性、良好生物相容性,能在体内保护和运输小RNA,还有工程化穿越血脑屏障的潜力。基于此,研究团队基于合成生物学原理,创新设计了一个靶向TDP-43的体内自组装siRNAs合成构建体(质粒DNA形式),包含CMV高效启动子、TDP-43 siRNAs表达骨架以及靶向神经元的RVG-Lamp2a融合蛋白标签。体内自组装siRNAs静脉注射后被肝脏摄取,肝脏细胞表达各功能模块,合成pre-miRNA经内源性加工形成成熟TDP-43 siRNAs,并自发组装到RVG肽修饰的小细胞外囊泡中。这些小细胞外囊泡携带TDP-43 siRNAs进入血液循环,在RVG靶向标签作用下高效穿越血脑屏障,递送至神经中枢系统,靶向TDP-43 mRNA,降低其表达水平。
为评估体内自组装siRNAs减轻TDP-43相关病理的治疗效果,研究团队通过立体定向注射突变TDP-43病毒到纹状体,构建TDP-43疾病小鼠模型,每周两次给药体内自组装siRNAs,持续四周。结果显示,治疗后TDP-43模型小鼠运动功能障碍改善,外源性TDP-43表达水平降低,神经元丢失和胶质细胞增生减少,表明靶向TDP-43的体内自组装siRNAs具有治疗潜力。
基于上述研究,研究团队进一步开发长效体内自组装siRNAs递送策略。利用AAV8高效靶向肝细胞的能力,将其与靶向TDP-43的体内自组装siRNAs结合,实现肝脏中长效稳定表达,单次静脉注射即可实现长期持续治疗效果。该策略减少给药次数,治疗效果良好,临床适用性强,为TDP-43相关神经退行性疾病长期治疗提供了良好应用前景的给药方案。
论文共同通讯作者闫森表示,新策略克服了传统siRNA递送方法的局限,为治疗肌萎缩侧索硬化症和额颞叶痴呆等TDP-43相关神经退行性疾病提供了更简便、高效的治疗策略。
相关论文信息:https://doi.org/10.1093/brain/awaf330
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。