中山大学肿瘤防治中心主任医师蔡木炎、研究员谢丹团队研究揭示了切除修复交叉互补基因6样蛋白2-CtBP相互作用蛋白(ERCC6L2-CtIP)相分离凝聚体精细调控脱氧核糖核酸(DNA)末端切除程度的新机制,为理解DNA修复核心环节的精准调控提供了全新的介观理论,并为克服共济失调-毛细血管扩张症突变蛋白(ATM)抑制剂耐药(ATMi)提供了潜在新策略。相关成果9月5日发表于《自然-细胞生物学》。
 相关研究示意图。研究团队供图
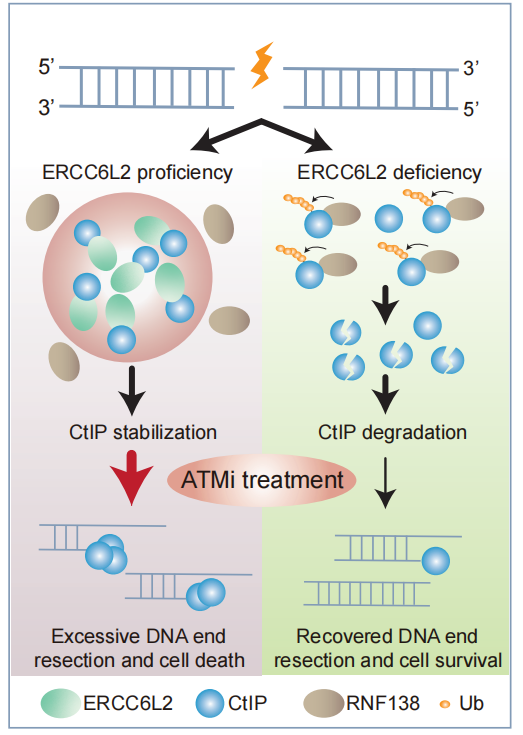
相关研究示意图。研究团队供图
?
DNA双链断裂是最严重的DNA损伤类型之一,其精确修复对维持基因组稳定性至关重要。真核细胞主要通过非同源末端连接和同源重组两种途径修复DNA双链断裂,而DNA末端切除的启动及其程度是决定修复路径选择的关键分子事件。尽管该过程的核心蛋白组分已被初步阐明,但细胞如何控制切除程度以防止“修复不足”或“过度切除”,仍是该领域未解决的核心科学问题。
研究团队通过全基因组CRISPR-Cas9筛选发现ERCC6L2是调控DNA末端切除的关键因子。ERCC6L2通过其固有无序区发生液-液相分离,形成具有生物活性的核内凝聚体,并特异性地招募CtIP至该液相环境。在分子机制上,该凝聚体通过建立动态隔室化微环境,空间阻遏E3泛素连接酶RNF138对CtIP的识别,从而保护CtIP免于泛素化降解,维持其蛋白稳定性并精确调控切除程度。活细胞成像和荧光漂白恢复实验证实该凝聚体具备快速分子交换与融合等典型液相行为,表明相分离不仅作为“分子聚集器”,更通过建立空间屏障实现对修复因子的精准调控。
组织学分析显示,ERCC6L2在多种人类肿瘤中表达下调,且与CtIP水平呈正相关。TCGA泛癌数据分析提示,ERCC6L2低表达可能是肿瘤细胞获得ATM抑制剂耐药的一种适应性机制。这一发现为临床ATM抑制剂疗效预测和分层治疗提供了理论依据:检测ERCC6L2表达水平有望成为评估患者ATM抑制剂敏感性的潜在生物标记物。此外,未来通过恢复或模拟ERCC6L2–CtIP凝聚体功能,也可能成为克服ATMi耐药的新策略。
该研究建立了“相分离-泛素化”协同调控DNA末端切除的分子模型,系统阐明了ERCC6L2–CtIP生物分子凝聚体在精确控制切除程度中的核心功能。这一发现为阐释“细胞如何动态控制DNA末端切除程度”这一关键科学问题提供了新线索,从相分离这一新视角拓展了对DNA修复精密调控的理论认知,也为相关肿瘤的靶向干预提供了新的策略。
相关论文信息:https://doi.org/10.1038/s41556-025-01760-4
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。