高效精准药物递送是新药研发和精准医疗的关键。然而,现有的药物递送策略在提高肿瘤治疗效果和改善预后方面仍面临巨大挑战,主要受限于靶向性、精准释放以及肿瘤免疫抑制微环境等因素。
近日,中国科学院兰州化学物理研究所天然药物与化学测量研究中心海军人才团队与新疆大学合作,针对传统抗肿瘤药物递送系统的局限性,发展了一种“高效靶向+刺激响应+光热协同”智能响应抗肿瘤药物递送材料。相关论文发表于《胶体与界面科学杂志》。
传统化疗药物常因靶向性不足、释放失控导致疗效受限。研究团队针对这一难题,创造性地将一氧化氮供体L-精氨酸负载于具有近红外光响应特性的中空硫化铜纳米颗粒,构建出直径240纳米左右的智能递送载体。通过表面修饰肿瘤靶向肽RGD,该系统可主动识别肿瘤组织特异性标志物,实现药物在病灶部位的高效富集。实验数据显示,在近红外光精准照射下,药物靶向效率较传统疗法提升4.7倍,显著降低对正常组织的非特异性损伤。
该系统的创新核心在于多重治疗机制的协同作用。当近红外光激活时,中空硫化铜纳米颗粒产生温和光热效应,促使肿瘤血管扩张、渗透性增强,为药物深度渗透开辟通道。与此同时,纳米载体逐步降解释放铜离子,触发肿瘤细胞特有的"铜死亡"通路。更值得关注的是,一氧化氮与活性氧/氮物种(ROS/RNS)的协同风暴在肿瘤微环境中形成多重打击,这种"化学动力学-光热-气体治疗"的立体攻势使肿瘤体积缩减达90%,治疗效果远超单一治疗模式。
研究团队通过荧光-光声双模态成像技术,首次完整揭示了该系统的治疗作用链。在三阴性乳腺癌动物模型中,智能载体不仅实现药物的精准时空控制释放,更通过诱导免疫原性细胞死亡,将原本"沉默"的冷肿瘤转化为免疫活跃的"热肿瘤"。
联合免疫检查点抑制剂治疗后,肿瘤微环境发生显著改变:树突状细胞成熟度提升3倍,杀伤性T细胞浸润密度增加2.8倍,具有免疫抑制作用的M2型巨噬细胞向抗肿瘤M1型转化比例达76%。这种"化疗-光热-免疫"的三维联动,为打破肿瘤免疫逃逸机制提供了创新范式。
论文通讯作者兰州化物所研究员邸多隆表示,该研究构建了集智能递送、多模态治疗、免疫调节于一体的诊疗平台,特别适用于三阴性乳腺癌等难治性肿瘤。第一作者景泉博士透露,团队已启动系统的生物安全性评价,初步毒理研究显示主要脏器无明显损伤。
该成果获国家自然科学基金、中国科学院重点部署项目支持,已申请3项国家发明专利,其转化应用有望重塑肿瘤治疗格局,为患者带来更精准、更安全的治疗选择。
相关论文信息:https://doi.org/10.1016/j.jcis.2025.02.186
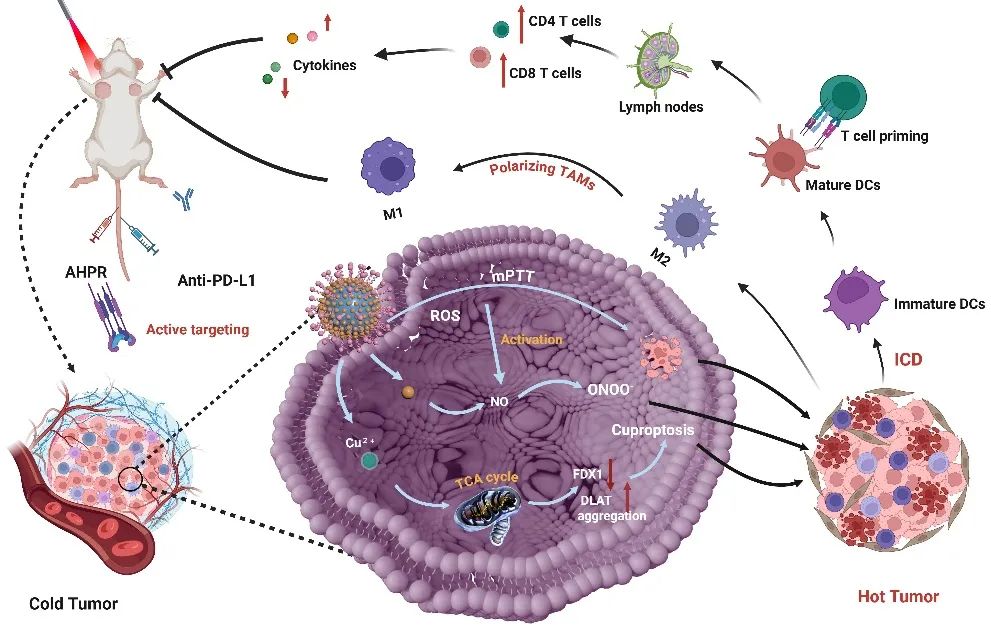 智能响应抗肿瘤药物递送材料作用机制。兰州化物所供图。
智能响应抗肿瘤药物递送材料作用机制。兰州化物所供图。
?
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。