中山大学肿瘤防治中心研究员康铁邦、副研究员武远众团队研究发现,ASB7扩增会导致基因组不稳定,同时赋予肿瘤对PARP抑制剂(PARPi)的敏感性。这一发现未来或可为ASB7扩增型肿瘤患者提供新的治疗思路,相关成果5月30日发表于《科学》(Science)。
 ASB7扩增赋予肿瘤对PARP抑制剂敏感性。研究团队供图
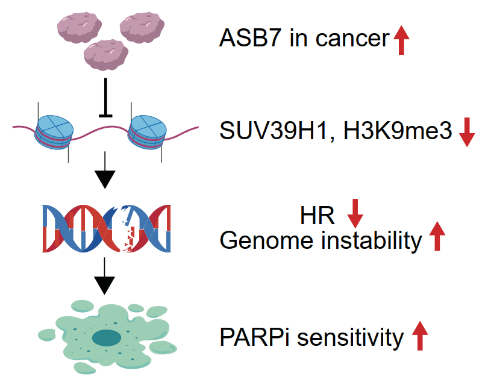
ASB7扩增赋予肿瘤对PARP抑制剂敏感性。研究团队供图
?
组蛋白H3第9位赖氨酸三甲基化(H3K9me3)在维持异染色质结构、基因沉默和DNA损伤修复中发挥关键作用,H3K9me3失调可导致基因组不稳定及癌症发生发展。H3K9me3的建立依赖于阅读器HP1对已有修饰的识别,进而招募书写器甲基转移酶SUV39H1,后者通过甲基化邻近组蛋白形成“读-写”正反馈循环。这一过程必须被严格调控,以防止H3K9me3过度沉积和异染色质异常形成,从而避免细胞损伤。但目前在高等生物体内限制这种正反馈以维持H3K9me3表观遗传稳态的具体机制仍不清楚。
研究团队通过全基因组范围的CRISPR-Cas9遗传学筛选,发现E3泛素连接酶ASB7是H3K9me3的核心负调控因子。在调控机制上,H3K9me3的阅读器HP1可招募ASB7至异染色质区域降解SUV39H1,这一过程受到细胞周期激酶CDK1-Cyclin B1严密控制,进入有丝分裂M期后,CDK1磷酸化ASB7并阻断其对SUV39H1的泛素化降解,保障了H3K9me3在随后细胞周期中的重建。该研究表明,在哺乳动物体细胞(含肿瘤细胞)中,“读-写-降解”平衡,而非经典的“读-写-擦除”平衡,可能是H3K9me3维持表观遗传稳态的基本机制。
DNA双链断裂损伤位点会发生H3K9me3修饰,进而激活下游级联损伤修复通路。ASB7在多种肿瘤中呈现扩增状态,这导致双链断裂位点的H3K9me3修饰水平不足,进而引起同源重组修复受损。细胞及动物实验表明,ASB7高表达增强了肿瘤细胞对PARP抑制剂的敏感性。这提示:ASB7扩增型肿瘤患者可能是PARP抑制剂的潜在获益人群。
相关论文信息:https://doi.org/10.1126/science.adq7408
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。