中国科学院上海药物研究所研究员徐华强、徐有伟团队,成功解析了人源前列腺素E2(PGE2)与其受体EP1及异源三聚体Gq蛋白复合物的高分辨率结构,揭示了PGE2识别并激活EP1受体的分子机制。相关研究成果近日发表于美国《国家科学院院刊》。
PGE2是一种源自花生四烯酸代谢的内源性脂质分子,参与炎症反应、血管舒张、痛觉感知等多种生理过程,通过结合EP1-EP4四种亚型的G蛋白偶联受体(GPCRs)发挥功能。尽管EP2、EP3和EP4与PGE2及G蛋白的复合物结构已相继被解析,EP1受体由于其结构不稳定性,始终未能获得高分辨率结构,严重制约了对其信号机制的深入理解。
为解决此问题,研究团队利用冷冻电镜技术获得了分辨率为2.55 ?的人源PGE2-EP1-Gq复合物三维结构,系统解析了PGE2被EP1识别并激活下游信号的通路。分析结果显示,EP1激活过程中,其第六跨膜螺旋(TM6)的位移幅度明显小于其他亚型受体,提示其具有独特的构象变化与激活模式。
进一步研究发现,EP1在与Gq蛋白偶联时展现出前列腺素家族中既保守又特异的模式。研究团队鉴定出了11个在Gq偶联中高度保守的关键残基,同时发现,不同受体之间偶联机制,EP1存在未参与Gq相互作用的残基。
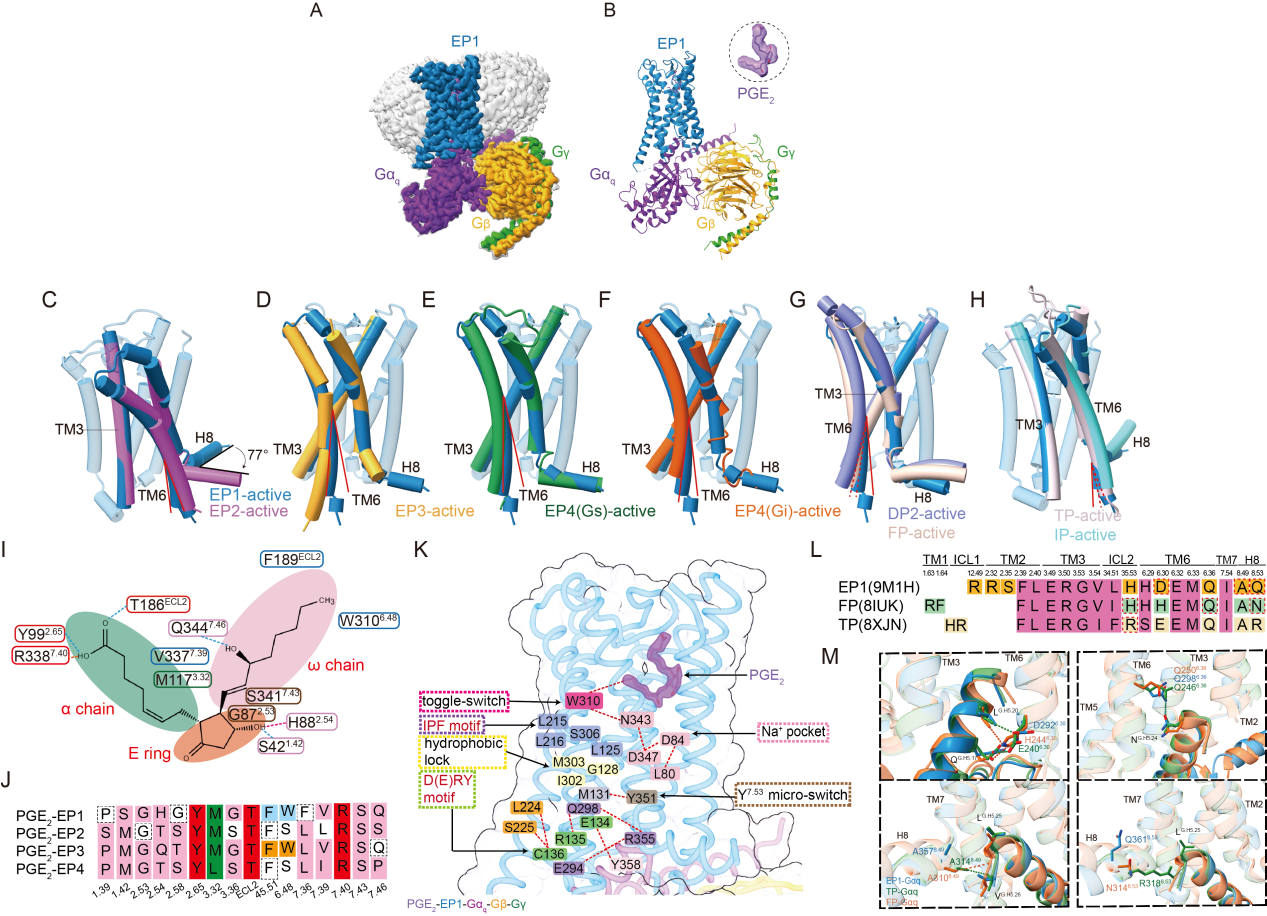 PGE2结合并激活EP1受体的独特机制。图片由研究团队提供
PGE2结合并激活EP1受体的独特机制。图片由研究团队提供
?
研究团队表示,这项研究不仅首次揭示了EP1受体激活及Gq偶联的三维结构图谱,完善了前列腺素受体家族的结构信息,也为未来开发靶向EP1的高选择性药物提供了理论依据。
相关论文信息:http://doi/10.1073/pnas.2423840122
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。