中国科学院上海药物研究所研究员李佳和临港实验室研究员臧奕合作,发现高血糖可通过调节中央前额叶皮层和腹侧海马的神经元趋化因子2(CCL2)及神经免疫细胞活化,促进糖尿病的小鼠焦虑行为,且该机制在外周代谢紊乱与焦虑障碍的疾病交互中发挥关键作用。5月6日,相关研究发表于《自然-代谢》。
已有研究表明,焦虑障碍在糖尿病人群中有较高的发生率,并损害糖尿病治疗的依从性。然而,目前针对糖尿病患者焦虑症的综合干预方案仍然有限,主要原因在于传统抗焦虑药物可能加重代谢问题,使患者难以从治疗中获益。
长期以来,“中枢胰岛素抵抗”被认为是糖尿病患者焦虑障碍的主要诱因,但最新研究揭示,全脑胰岛素受体敲除小鼠模型并未出现焦虑表型,亟需探索新的机制,揭示糖尿病—焦虑障碍共病的发生机制。
此外,糖尿病治疗的临床观察表明,使用非依赖胰岛素的降糖药物与较低的焦虑障碍风险相关,提示高血糖可能是糖尿病并发焦虑症的主要原因。然而,高血糖调控焦虑障碍的因果关系及具体机制仍不清楚。
研究团队利用糖尿病小鼠模型开展系列实验,发现CCL2在中枢神经系统和外周均显著上调,CCL2的全身敲除可有效缓解焦虑行为,特异性抑制中枢CCL2能改善焦虑症状,而外周CCL2的抑制无效。此外,CCL2的表达主要集中在中央前额叶皮层和腹侧海马脑区,且特异性定位于神经元。高血糖可通过激活神经元渗透压感受器TonEBP,转录上调神经元CCL2的表达,从而促进焦虑行为的发生。
机制研究表明,CCL2通过结合趋化因子受体2 (CCR2)激活神经免疫细胞,诱导神经炎症,并进一步加剧焦虑行为,而广谱神经免疫抑制剂及CCR2抑制剂均能有效缓解焦虑症状。在高脂诱导的糖尿病小鼠中,该TonEBP-CCL2-焦虑轴仍然存在,且非胰岛素依赖的降糖药物可改善焦虑表型。进一步研究发现,中央前额叶皮层和腹侧海马脑区的神经元特异性CCL2过表达可诱发焦虑行为,神经元的TonEBP-CCL2轴及相关炎症通路在糖尿病患者大脑中显著上调。
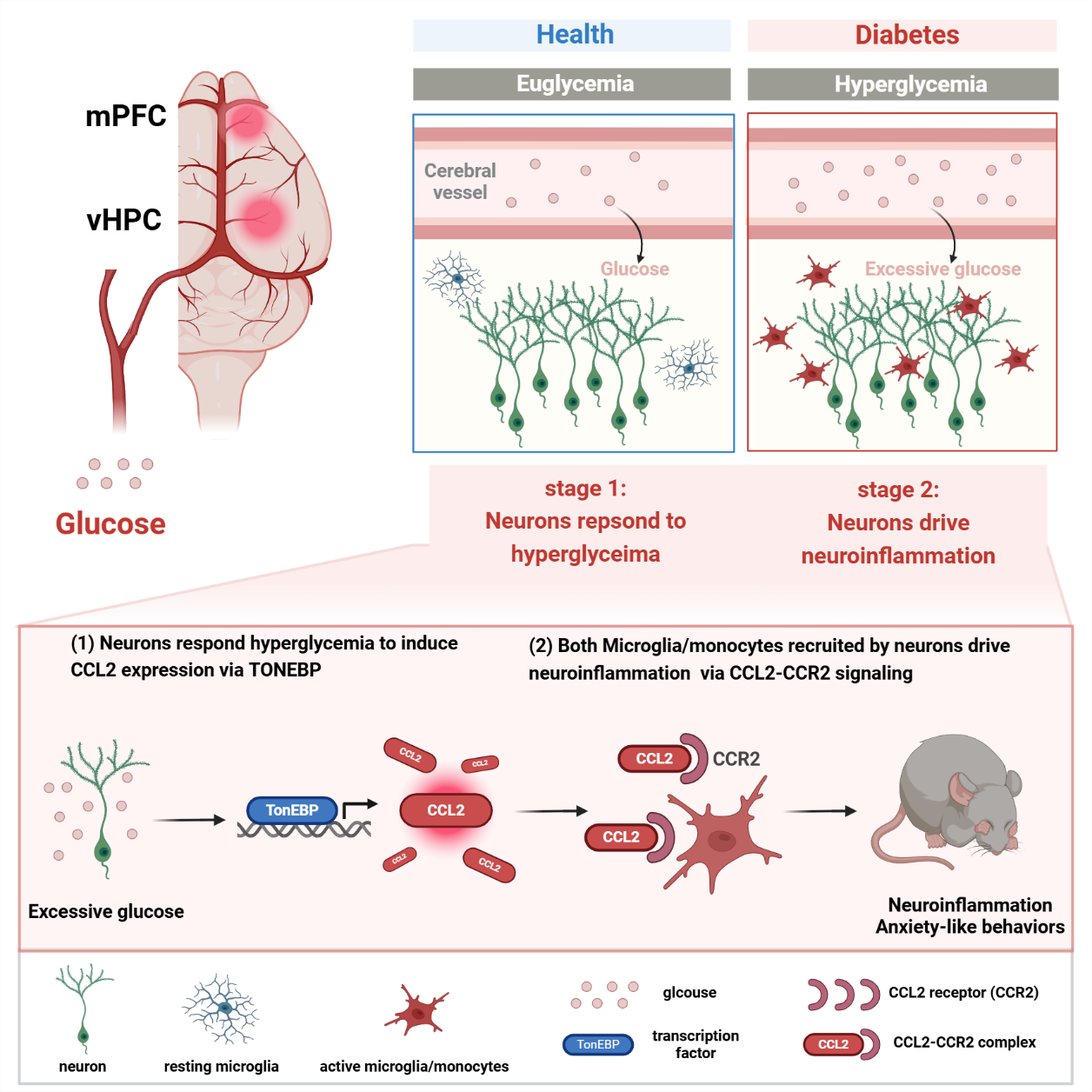 神经元CCL2作为糖尿病和焦虑障碍的疾病交互关键机制。图片由研究团队提供
神经元CCL2作为糖尿病和焦虑障碍的疾病交互关键机制。图片由研究团队提供
?
相关论文信息:http://doi.org/10.1038/s42255-025-01281-2
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。