近日,西安交通大学基础医学院研究员李观营团队与松山湖材料实验室智能软物质团队合作,成功开发一种无需光激活的新型钌基纳米药物——Ruthenosome(钌脂质体)。该药物能够高效靶向线粒体,激活铁蛋白自噬,从而诱导铁死亡,为破解肿瘤耐药性提供了一种全新的策略。相关成果发表于《美国化学学会纳米杂志》(ACS Nano)。
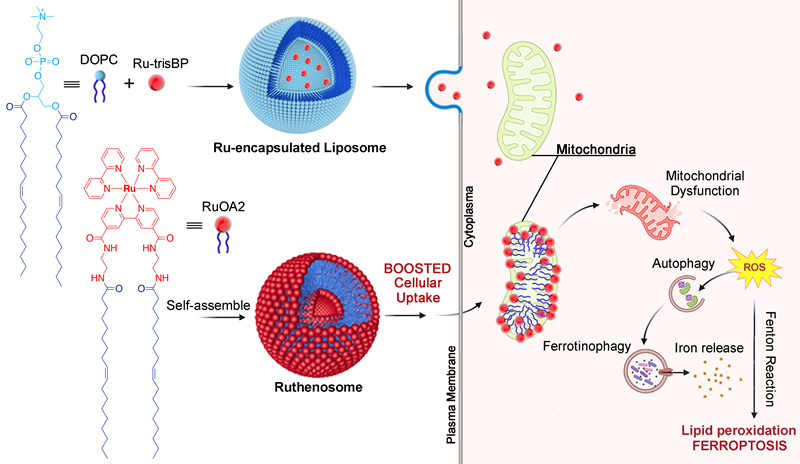 钌配合物通过自组装形成Ruthenosome,诱导铁死亡的示意图。研究团队供图
钌配合物通过自组装形成Ruthenosome,诱导铁死亡的示意图。研究团队供图
?
传统化疗主要通过诱导细胞凋亡来杀伤癌细胞,但肿瘤常通过抑制凋亡或耐药机制逃脱治疗,削弱化疗效果。因此,非凋亡型细胞死亡成为研究热点,其中铁死亡因其代谢依赖性和肿瘤特异性,在抗癌领域备受关注。
铁死亡由铁依赖性脂质过氧化驱动,许多肿瘤因高活性氧水平和异常铁代谢对其尤为敏感。研究表明,铁死亡不仅能抑制肿瘤生长,还能增强免疫系统识别,有望克服耐药性。然而,现有铁死亡诱导剂仍面临特异性低、细胞摄取差、活性氧调控不足等挑战,因此,如何精准高效地诱导铁死亡成为该领域的核心问题。
基于钌(II)复合物RuOA2,研究人员通过分子设计实现其自发组装为动态多层囊泡(Ruthenosome),兼具脂质体递送和活性氧生成功能。油酸尾链修饰显著提升其在癌细胞摄取率,增强药效。Ruthenosome表面带正电,通过静电作用选择性富集于癌细胞线粒体。进入线粒体后,显著提高羟基自由基水平,诱导铁蛋白自噬和铁离子释放,驱动脂质过氧化并激活铁死亡,有效杀伤癌细胞。Ruthenosome不依赖光激活,在结直肠癌、乳腺癌、胰腺癌等多种肿瘤模型中均表现出广谱抗癌能力。动物实验显示,其抑瘤率高达80%,且无明显肝肾毒性,具备良好生物安全性。
该研究提出基于铁死亡的全新抗癌策略,尤其适用于耐药性肿瘤(如高突变负荷的结直肠癌和胰腺癌)。相比传统铁死亡诱导剂,Ruthenosome无需光激活、具备线粒体精准靶向和高细胞摄取率等优势,为临床肿瘤治疗提供高效、安全、广谱的新方案。目前,研究人员正推进粒径优化和静脉注射研究,助力临床转化。
相关论文信息:https://doi.org/10.1021/acsnano.4c17344
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。