近日,西安交通大学前沿科学技术研究院教授何刚课题组以含硒紫精四阳离子铑配位环蕃为基础,与辅因子自组装成一种新型超分子人工辅因子(SeV-Rh-Box?NAD+)。
该成果成功结合了超分子化学、光催化和生物催化三个领域,不仅拓展了紫精基材料在光酶催化中的应用,也为解决光酶催化体系中长期存在的空间分离与电子转移效率低下难题提供了新的分子设计思路与理论依据。研究成果发表在《美国化学会志》。
受天然光合作用电子传递过程的启发,光生物催化将光催化与酶催化耦合,形成协同体系,能够在温和且环保的条件下合成手性药物和精细化学品等复杂分子。光催化剂在光生物催化中起核心作用,通过光诱导的电子转移、辅因子的再生或直接激活酶促反应来驱动酶催化过程。尽管光催化剂已被用于再生辅因子并实现光驱动的不对称合成,但光催化剂在生理条件下的不稳定、光催化剂与酶之间电子转移效率低下、光催化剂可能导致的酶失活等问题仍然限制了光生物催化体系的实际应用。
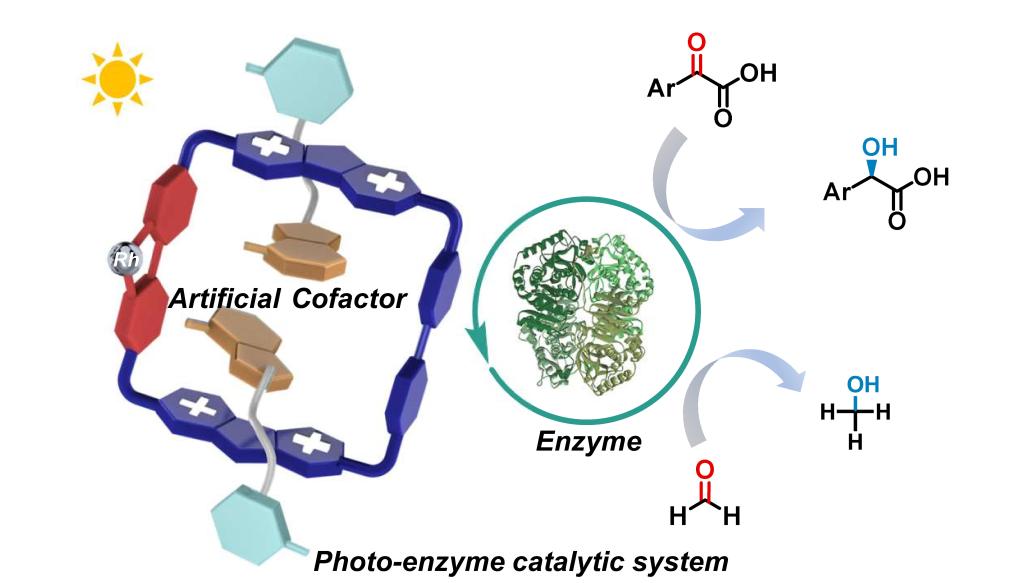 新型超分子人工辅因子示意图。西安交通大学供图
新型超分子人工辅因子示意图。西安交通大学供图
团队研究表明,新型超分子人工辅因子在保持与生物体系良好相容性的同时,实现了高效且稳定的光诱导电子传递,与醇脱氢酶整合后形成紧凑、光响应且具有仿生特性的光-酶催化体系。瞬态吸收光谱与电化学研究揭示,超分子结构促进分子内定向电子转移,从而高效再生辅因子并提升整体光催化性能,可在可见光照射下实现药物分子扁桃酸衍生物的手性合成。该光酶系统展现出高对映选择性、优异产物收率及超过47,740的周转数,并以高收率合成了神经药物后马托品和心血管药物环扁桃酯,彰显出其在光催化不对称合成中的实际应用价值。
相关论文信息:https://doi.org/10.1021/jacs.5c18091
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。