10月23日,记者从暨南大学获悉,该校研究员闫森、教授李晓江团队在肌萎缩侧索硬化症(ALS,俗称渐冻症)动物模型研究领域取得重大突破,成功构建出能快速稳定模拟人类ALS多种核心特征的猪模型。相关成果发表于《美康》(MedComm)。
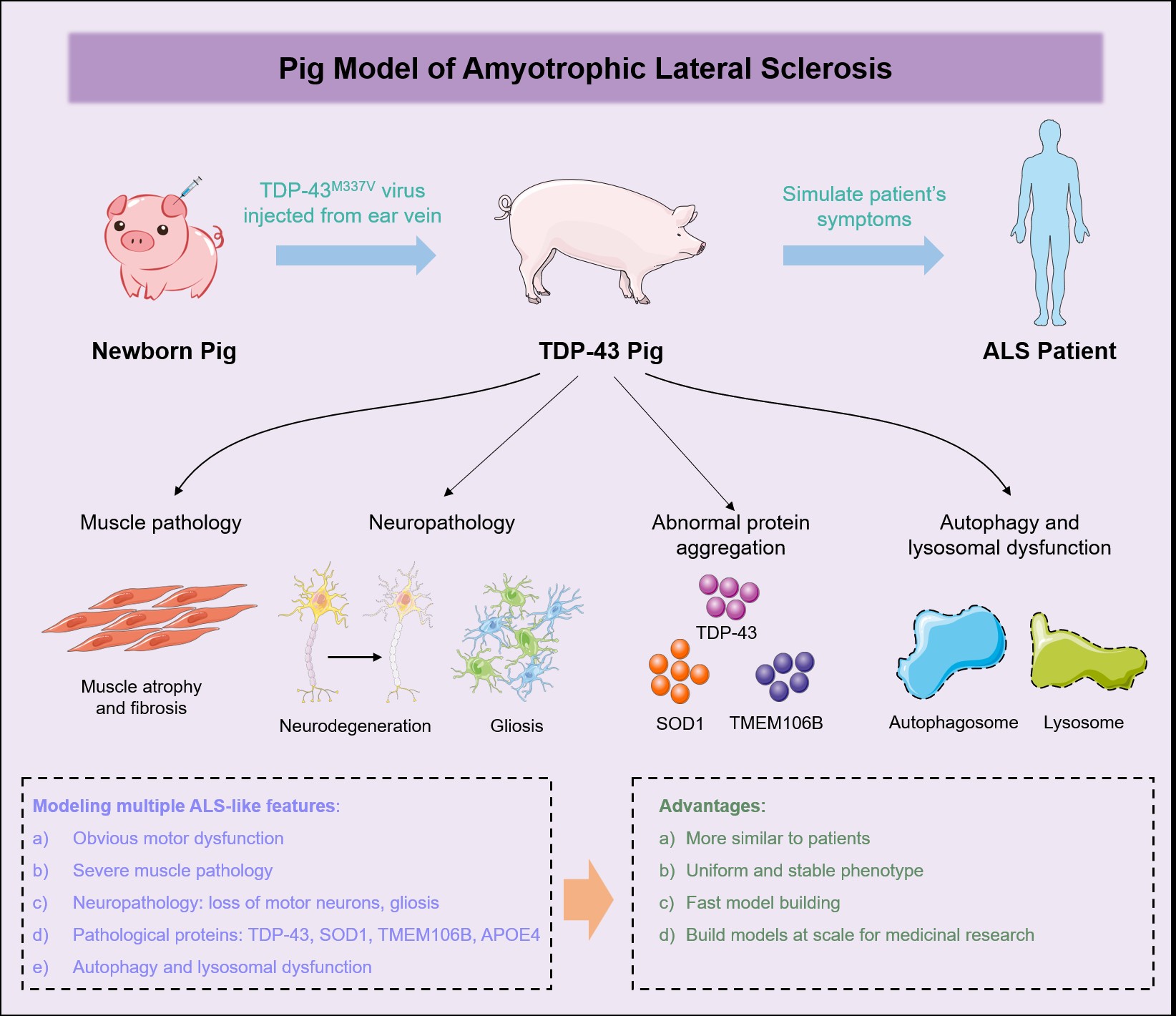
论文通讯作者闫森向《中国科学报》介绍,研究团队借助过表达TDP-43(M337V)的病毒载体,高效且稳定地构建出全新的ALS猪模型。该模型精准复现了ALS的多种标志性病理特征,为深入探究ALS中突变TDP-43驱动的致病机制,以及这些病理事件在疾病进展中的相互作用,提供了独特且宝贵的研究平台。
记者了解到,ALS作为一种极具破坏性的神经退行性疾病,主要累及上下运动神经元,患者会经历进行性肌肉无力与萎缩,病情迅速恶化,最终导致瘫痪甚至死亡。对于ALS患者而言,时间就是生命,然而,缺乏能真实模拟人类疾病的动物模型,始终是新药研发进程中的最大阻碍。
 耳静脉注射突变AAV-TDP-43(M337V)病毒可在猪中产生了严重的ALS样运动障碍和行为缺陷。研究团队供图
耳静脉注射突变AAV-TDP-43(M337V)病毒可在猪中产生了严重的ALS样运动障碍和行为缺陷。研究团队供图
?
TDP-43蛋白是ALS的罪魁祸首之一,在超过95%的ALS患者中,这种本应待在细胞核内的蛋白错误地跑到细胞质中并聚集成块,导致运动神经元逐渐死亡,大脑指令无法传达到肌肉,最终使人陷入“冰冻”状态。多年来,科学家们主要依靠转基因小鼠来研究ALS。
但小鼠模型存在明显局限:疾病进程太快,无法模拟人类的慢性病程;大脑结构简单,难以观察复杂变化;最重要的是,许多在小鼠身上有效的药物,在人类临床试验中纷纷折戟沉沙。因此,我们急需一个更接近人类的“替身”来帮助我们测试药物。
大动物模型因与人类大脑结构和生理功能更为相似,成为理想选择。例如,TDP-43相关的猪模型和猴模型中,均存在与患者相似的TDP-43胞质异常定位现象。相较于非人灵长类动物,猪模型具备快速大规模繁殖的优势,能够为ALS病理研究和治疗开发提供充足的样本。
为此,研究团队将AAV-TDP-43(M337V)病毒递送至新生猪体内。该病毒携带的SYN启动子,可确保分布在中枢神经系统的病毒成功表达外源性的突变TDP-43(M337V)。
在行为层面,猪模型出现了进行性后肢无力、步履蹒跚、肌肉萎缩以及纤维化增加等症状,与患者的运动功能退化过程高度相似。病理检查发现,其脊髓和大脑的运动神经元中,呈现出典型的TDP-43病理特征:细胞核内的TDP-43消失,取而代之的是细胞质中堆积的有毒蛋白团块,同时伴有磷酸化TDP-43的积累。细胞水平上,猪模型的上下运动神经元大量丢失,还伴有显著的神经炎症反应,转录水平也与ALS患者相近。此外,研究团队发现该TDP-43猪模型呈现出其他ALS动物模型未曾出现的神经退行性疾病共同特征。
例如,TMEM106B作为多种神经退行性疾病的风险基因,会影响溶酶体功能,导致细胞内TDP-43清除受阻,促进TDP-43异常聚集。研究发现,TDP-43猪脊髓和运动皮层中TMEM106B表达水平显著升高,且细胞质内出现TMEM106B聚集体。超氧化物歧化酶1(SOD1)作为关键抗氧化酶和首个被发现的ALS主要遗传风险因子,在疾病发生发展中作用关键。
该研究发现TDP-43猪脊髓及脑组织中SOD1水平显著升高,成功复现了ALS的这一重要病理特征。载脂蛋白E(APOE)的APOE4亚型与TDP-43病理密切相关,可能加剧TDP-43积聚,但现有动物模型尚未直接证实二者的机制关联。此次研究在过表达TDP-43的猪模型中,首次观察到脊髓和运动皮层APOE4水平升高,为这一关联提供了直接证据。
该TDP-43猪模型成功概括了多种关键的ALS病理特征,为探索ALS全新机制、评估潜在治疗方法以及推进药物开发工作提供了重要价值。“尽管将这一成果转化为治愈患者的疗法仍任重道远,且大型动物模型成本高昂,但这项研究无疑是对抗ALS征程中的重要里程碑。”闫森说。
相关论文信息:https://doi.org/10.1002/mco2.70330
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。