1月6日,《柳叶刀-肿瘤学》发表了中山大学肿瘤防治中心教授徐瑞华团队一项具有里程碑意义的临床研究:靶向Claudin 18.2的抗体偶联药物(CMG901)治疗晚期胃癌/胃食管结合部腺癌患者的I期临床试验结果。该药物在治疗晚期胃癌及胃食管结合部腺癌方面表现出显著疗效与良好的安全性。这也是全球首个针对Claudin 18.2靶点的抗体偶联药物临床研究报道。
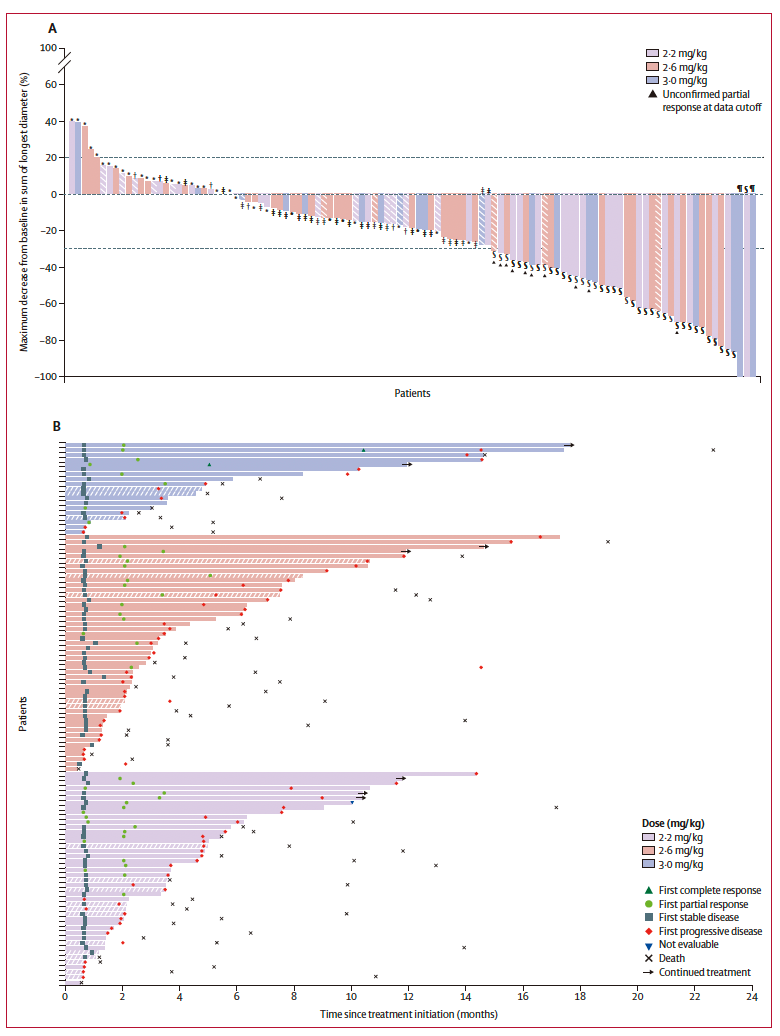
胃癌/胃食管结合部腺癌(A.最佳总体疗效;B.治疗反应的持续时间)。研究团队供图
?
据悉,CMG901(AZD0901)作为一种潜在的全球首创、靶向Claudin 18.2的ADC,通过其独特的链接体与单甲基奥瑞他汀E(MMAE)的结合,展现了其在临床前研究中的卓越效果。CMG901能够特异性地与细胞表面的Claudin18.2结合,并通过直接细胞毒性、抗体依赖性细胞毒性、补体依赖性细胞毒性以及旁观者杀伤效应来消灭肿瘤细胞。而Claudin 18.2在胃癌、食管癌、胰腺癌等多种恶性肿瘤中呈现高特异性表达,因此成为胃癌靶向治疗的理想靶点。
此次研究纳入134名多线标准治疗后失败的癌症患者进行研究,这些患者均为多线标准治疗后失败的患者。最终发现,该药物在胃癌及胃食管结合部腺癌的治疗中表现出显著疗效。其中,Claudin 18.2高表达患者的中位无进展生存期为4.8个月,中位总生存期为11.8个月。研究最终确定CMG901的推荐剂量为2.2 mg/kg,为后续III期研究的开展提供了支持,提示CMG901有望在未来成为Claudin 18.2高表达胃癌/胃食管结合部腺癌患者的治疗新选择。
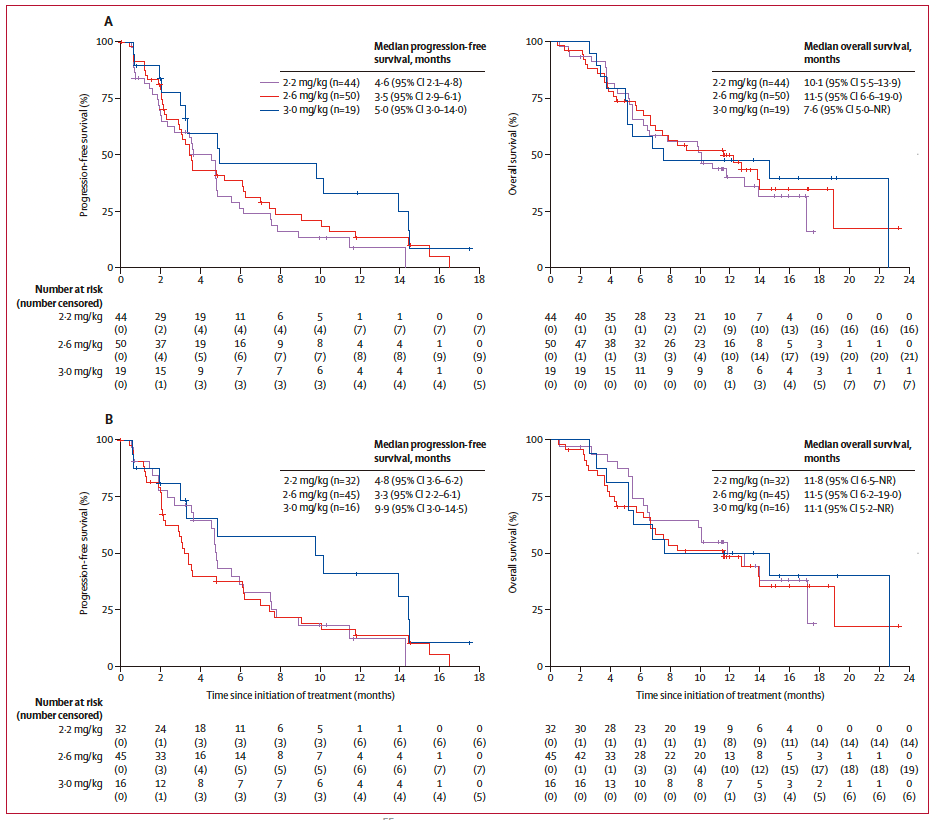
研究中PFS和OS的Kaplan-Meier曲线。研究团队供图
?
在安全性方面,CMG901同样表现良好。在剂量递增阶段,仅2.2 mg/kg组1例患者发生剂量限制性毒性,未达到最大耐受剂量。在剂量扩展阶段,虽然68%的患者发生了≥3级治疗期不良事件(TEAEs),但最常见的≥3级TEAEs是中性粒细胞计数降低(21%)、贫血(14%)和呕吐(10%)。治疗相关的毒性在充分的支持治疗中可得到缓解,患者整体耐受良好。
据介绍,CMG901(AZD0901)目前正在开展国际、多中心III期研究,探索CLDN18.2表达的晚期实体患者中,CMG901(AZD0901)单药与研究者选择标准治疗的疗效和安全性比较。临床研究地点涵盖美国、英国、法国、德国等,代表了我国自主研发的Claudin 18.2抗体偶联药物走出国门,有望在未来获得欧美国家的适应症批准,为全球晚期胃癌/胃食管结合部腺癌患者带来福音。
相关论文信息:https://doi.org/10.1016/S1470-2045(24)00636-3
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。