|
|
|
|
|
实验结构仍是关键!AlphaFold3预测GPCR-配体复合物评测 |
|
|
中国科学院上海药物研究所研究员徐华强团队,收集了AlphaFold3(AF3)发布后的G蛋白偶联受体(GPCR)-配体复合物实验结构,并从整体结构的准确性、口袋预测能力、复合物预测能力和可变区预测效果方面全面评估了AF3在GPCR-配体复合物方面的表现,并为进一步改进蛋白质结构预测工具提出了建议。12月6日,相关研究发表于《中国药理学报》英文版。
自2024年5月AF3发布以来,已有多个相关工作复现了AF3的预测性能,并开放源代码供学术界使用。然而,AF3的预测表现尚缺乏在真实应用场景中的评估,特别是其新加入的配体预测模块。
考虑到GPCR是重要的药物靶标,其与配体的相互作用是药物开发的重要方向,且具有高度复杂性,结构生物学也在此领域做出了大量工作,徐华强团队使用AF3服务器对其配体预测能力进行了评测,包括整体结构准确度、配体定位、口袋形状和受体结构变化。
团队选取了35个在AF3文章投稿后发布的GPCR结构进行评测。整体来看,AF3相比AF2在结构预测能力上有所提升,整体预测能力未因配体的加入而受到影响。四类GPCR的预测结果显示,AF3仅在一些天生可变的区域存在和实验结果不一致的预测,同时在大蛋白复合体的预测方面AF3还有待提升。
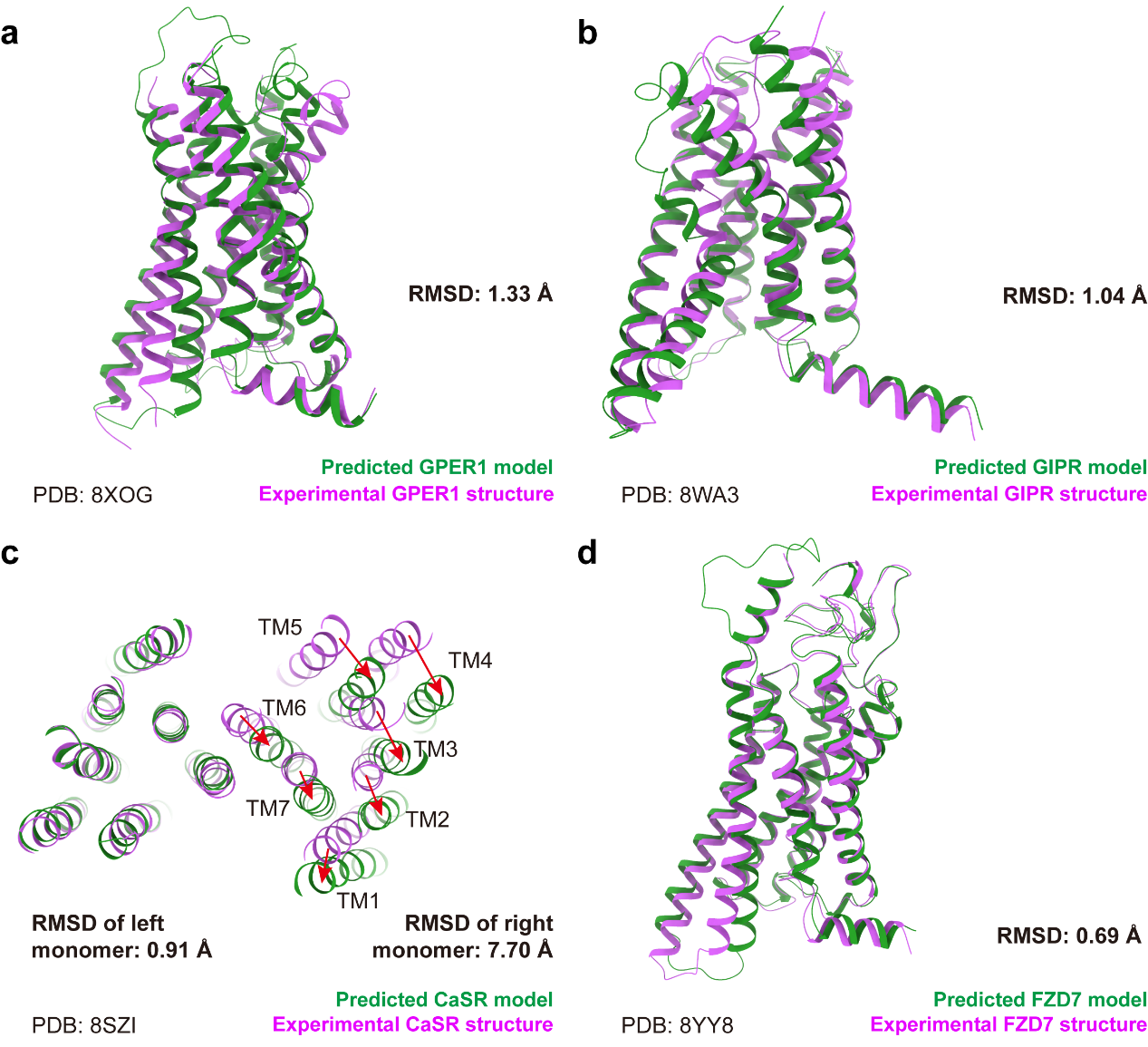 AF3预测结构和实验结构的整体对比。图片来源于《中国药理学报》英文版
AF3预测结构和实验结构的整体对比。图片来源于《中国药理学报》英文版
?
通过对AF3的评测,文中展示了AF3相较于前代AF2的进步,并证明了AF3在缺乏实验先验知识时具有一定的模型价值。侧链构象的预测和四级结构的组装仍是其主要挑战。此外,AF3在不同GPCR家族的泛化能力及动态区域的预测能力也需要进一步提高。目前,AF3仍不足以支持可靠的药物开发和应用,需依赖实验验证和算法的进一步优化,而非完全替代实验结构生物学。
文中同时展示了一些可能的算法改进方向。例如,引入物理化学原则的编码信息,可能有助于减少配体与受体之间的碰撞;对多肽类配体进行原子级建模。可能提升其预测能力;类似于ESM3在结构预测中引入功能信息的做法,在AF3中引入生物学原则的信息,可能帮助避免G蛋白位置预测的重大失误,基因测序信息以及突变与表型之间的关联信息也可能提供有价值的参考。在这些改进下,AF3的预测有望为序列-结构-功能关系提供更全面的理解,并为药物设计提供更强有力的支持。
相关论文信息:https://doi.org/10.1038/s41401-024-01429-y
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。