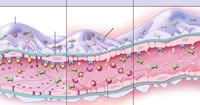
肾小球血栓性微血管病发生的假说模型(图片来源:N EngL J Med 2008, 358(11):1135)
血管内皮生长因子(VEGF)抑制剂(如贝伐单抗)、遗传学方法(如基因敲除)和循环中可溶性VEGF受体1(sFlt-1)水平升高都可破坏生理性VEGF的功能,进而引发肾小球血栓性微血管病。
抗血管生成治疗是肿瘤治疗领域近年来最炙手可热的话题之一。血管内皮生长因子(VEGF)抑制剂贝伐单抗自2004年2月起,已相继获得美国FDA批准治疗结直肠癌、肺癌和乳腺癌。
随着贝伐单抗应用的日益广泛,其不良反应报告也日渐增多。蛋白尿和高血压是最常见的两种不良反应,发生率分别为21%~64%和3%~36%,其中肾小球性蛋白尿发生率为1%~2%。
肾小球性蛋白尿的发生原因,可能是一般性效应,如机体对贝伐单抗产生的免疫反应,也可能是特异性效应,即肾小球生理性VEGF受到抑制的结果。这两种病因很难区分。
日前,加拿大西奈山医院Samuel Lunenfeld研究所Eremina等的研究证实,在贝伐单抗治疗者中出现的肾小球损害,是由抗血管生成治疗所致肾小球生理性VEGF减少引起的。相关论文发表在3月13日的《新英格兰医学杂志》上。
6个真实详尽的临床病例
首先,Eremina等报告了6个贝伐单抗治疗的肾小球血栓性微血管病病例。这些患者的年龄从56岁到74岁,病种包括肝癌、肺癌、胰腺癌和卵巢癌,他们都在接受贝伐单抗治疗之后出现了蛋白尿和(或)高血压,肾脏病理都证实了肾小球血栓性微血管病的存在,而且,在停用贝伐单抗治疗后,患者的肾功能、蛋白尿和血压情况都能得到改善,提示这是一个一过性的、可逆性的过程。
在报告中,Eremina等不但提供了这些患者详尽的用药剂量和过程、临床和实验室检查结果,而且附上了清晰明了的肾脏病理图像。
这些结果提醒人们,需要重视VEGF抑制剂的肾脏毒性。鉴于这类药物在多种类型的肿瘤中显露出了令人印象深刻的治疗潜力,越来越多的患者即将接受这类药物治疗,认识并警惕其肾脏毒性具有重要的临床意义。
1项直接验证的动物实验
那么,贝伐单抗又是如何导致肾小球损害的呢?如果是特异性效应,即可以用肾小球生理性VEGF减少来解释,那么肾小球VEGF的局部减少是否足以引发血栓性微血管病呢?
为此,Eremina等应用小鼠模型进行了进一步研究。当肾小球足细胞(分泌VEGF的主要细胞)的VEGF基因被敲除后,实验小鼠无一例外地出现了肾小球损害,发生了蛋白尿、高血压,血中出现了红细胞碎片,肾脏病理呈现出肾小球血栓性微血管病的典型表现。
该小鼠模型为VEGF抑制剂所致肾小球损害的机制提供了直接实验室证据,表明通过遗传学方法破坏肾脏局部的VEGF产生,可导致临床病例同样的肾小球损害,支持“局部VEGF在微血管病发病过程中起关键性保护作用”的观点。
1个合乎表象的假说模型
由此,Eremina等建立了一个假说模型(见上图)以解释上述现象:足细胞分泌的VEGF是维持肾小球内皮细胞完整性所必需的,无论是通过药物还是遗传学方法,只要破坏了VEGF的功能,就可导致肾小球血栓性微血管病。
在贝伐单抗治疗期间,很多患者都可以有尿蛋白排泌量的增多,但其中很少为肾小球性蛋白尿。因此,如何在蛋白尿患者中检出显性肾小球疾病患者,具有重要的临床意义。当然,另一方面,由于肾小球通透性的改变是VEGF抑制的直接结果,因此蛋白尿在某种程度上也反映了药物的疗效。这一点也值得进一步研究。
总之,基于上述病例分析和实验室研究结果,研究者建议所有接受VEGF抑制剂治疗的患者监测肾功能、血压和蛋白尿,尤其是有肾脏疾病病史者。(来源:中国医学论坛报)
(《新英格兰医学杂志》(
NEJM),Volume 358:1129-1136 March 13, 2008,Vera Eremina, Susan E. Quaggin)