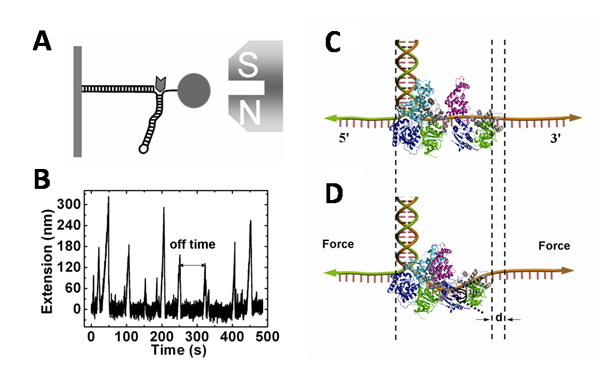
解旋酶是一种常见的马达蛋白,它以核酸单链为轨道沿着核酸链定向移动,并利用ATP水解提供的能量打开互补的核酸双链, 获得单链。解旋酶在DNA的复制、修复、重组以及转录等代谢过程都起着重要作用。但是人们迄今还没有完全理解解旋酶的解旋机制。单分子操纵技术帮助人们在单分子水平定量研究解旋酶的解旋动力学,是研究解旋酶分子机制的高端技术。大肠杆菌UvrD解旋酶是具有在DNA单链上由3′至 5′方向行走极性的解旋酶,有4个子功能域。关于UvrD各个子功能域的功能、它的解旋机制、特别是其有效的工作模式一直是争论的焦点(Cell,127(2006)1349; Nat. Rev. Mol. Cell Biol. 9(2008)391)。
最近,中国科学院物理研究所/北京凝聚态物理国家实验室李明研究组与法国国家科学中心奚绪光研究组合作,利用单分子磁镊装置以及带有发卡结构的DNA对UvrD解旋酶的解旋机制进行了深入研究。在低蛋白质浓度下,他们观察到了一系列单次DNA解旋过程,发现相邻两次解旋过程的时间间隔由两个相连的泊松过程控制,给出了UvrD双体工作模型的实验证据。特别是,他们还研究了外界拉力对UvrD解旋效率的影响,发现作用于DNA分开的两个单链端点、且使DNA失稳的拉力反而抑制该解旋酶的工作。这与以前报道过的T4解旋酶(PNAS,104 (2007) 19790)和T7解旋酶(Cell,129 (2007) 1299)有明显区别,说明UvrD是一个有特殊作用机制的马达蛋白。结合已经报道的UvrD解旋酶的晶体结构、生化实验数据以及上述实验结果,他们提出了一种应变蠕虫二聚体协同工作模型。他们认为UvrD单体的2B子功能域与双链DNA结合后阻止其解旋,也就是说有“自锁”效应。需要另一个UvrD与之结合,形成二聚体,后面一个UvrD的2B子功能域与前面一个UvrD的2B子功能域紧密结合,解除自锁,允许前一个UvrD完成解旋功能。此过程导致穿过该二聚体的DNA单链形成50度左右的弯折,将单链收缩约0.5-1.0 nm。从力学角度看,此解旋过程需要克服外力做功,从而导致解旋速度随外力的增加而降低。这种二聚体模型也与他们观察到的解旋动力学细节相互印证。例如,他们推断,二聚体在解旋过程中解体时会导致解旋暂停,且UvrD沿DNA单链反向行走会有两种不同的速度,分别代表UvrD单体和双体的行走速度。这些推论都被实验证实。该项工作的结果发表在2008年12月份的《EMBO杂志》上。
此项工作得到了蛋白质重大研究计划和基金委的资助。(来源:中国科学院物理研究所)
(《
EMBO杂志》(
The EMBO Journal), Ming Li,Xu Guang Xi)