《细胞》子刊《结构》(Structure)杂志于4月15日发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所丁建平研究员课题组的一项新研究成果,该项工作发现了小G蛋白与效应蛋白相互作用的一种新方式。
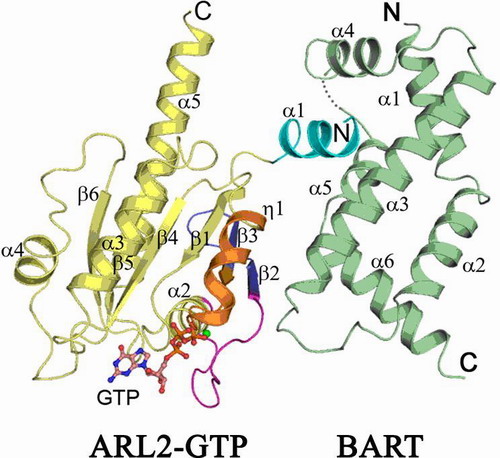
小G蛋白家族成员在信号通路中发挥分子开关的功能,参与调控很多生物学过程。当小G蛋白结合GTP时处于活性状态、结合GDP时处于非活性状态。小G蛋白激活后一般通过开关(Switch)区域与效应蛋白结合,从而调控下游信号通路。小G蛋白ARL家族成员ARL2参与细胞内微管组装的调控。此外,ARL2通过与效应蛋白BART的结合,维持 STAT3在细胞核内的定位,并参与线粒体ATP/ADP通道的调控。丁建平课题组博士生张天龙等运用结构生物学的方法解析了ARL2-GTP-BART复合物的晶体结构,发现ARL2以一种新的方式识别和结合BART,并进一步运用生物化学和分子生物学方法对ARL2-BART之间的相互作用进行了验证。目前发现的ARL家族其他成员通过开关区域与效应蛋白相互作用,其N端α螺旋通过脂酰修饰定位在高尔基体膜上、不参与效应蛋白的结合。而ARL2除了通过其开关区域识别BART外,还利用N端α螺旋识别和结合BART表面的一疏水口袋,以增强对效应蛋白的特异性识别和结合、从而精确调控下游信号通路。这种作用方式在小G蛋白与效应蛋白相互作用研究中是首次被发现。这一研究成果对进一步研究ARL家族成员的结构与功能的关系,阐释ARL家族成员之间、以及与其它小G蛋白的功能差异的分子基础具有重要意义。
该项工作得到国家科技部、国家自然科学基金、中国科学院和上海市科委的经费支持。(来源:中科院生化与细胞所)
(《结构》(
Structure),doi:10.1016/j.str.2009.01.014,Tianlong Zhang,Jianping Ding)